La couverture vaccinale HPV est en chute libre en France. Pourtant l’efficacité et la sécurité du vaccin sont établis. Les médecins avec l’appui des pouvoirs publics doivent soutenir la vaccination.
Le poids des infections au papillomavirus humain (HPV) en France est important, et ne peut être résumé aux 1 000 décès annuels par cancer du col utérin (malgré la prévention secondaire assurée par le frottis) (1), puisque dans notre pays près de 50 000 cas de verrues génitales sont prises en charge (2), auxquelles il faut ajouter 24 000 cas de lésions cervicales prémalignes (Cervical Intraepithelial Neoplasia, CIN) (3), dont le traitement comporte des risques obstétricaux. Les HPV à haut risque sont responsables de nombreux cancers induits (11,7 cas /100 000 sujets par an) et les femmes paient un plus lourd tribut que les hommes à ce fléau (13,5 cas / 100 000 / an vs 9,7 cas / 100 000 / an pour les Hommes) (4). Seul le cancer du col bénéficie d’un dépistage efficace, la prévention cancers ano-génitaux et ORL ne pouvant être aujourd’hui que primaire, c’est-à- dire reposant sur la vaccination (Tableau 1, Figure 1). Dernier point, 79 % des cancers ano-génitaux et ORL sont imputables aux hrHPV, et 80 % de ces cancers viro-induits sont dus à HPV 16 et 18.
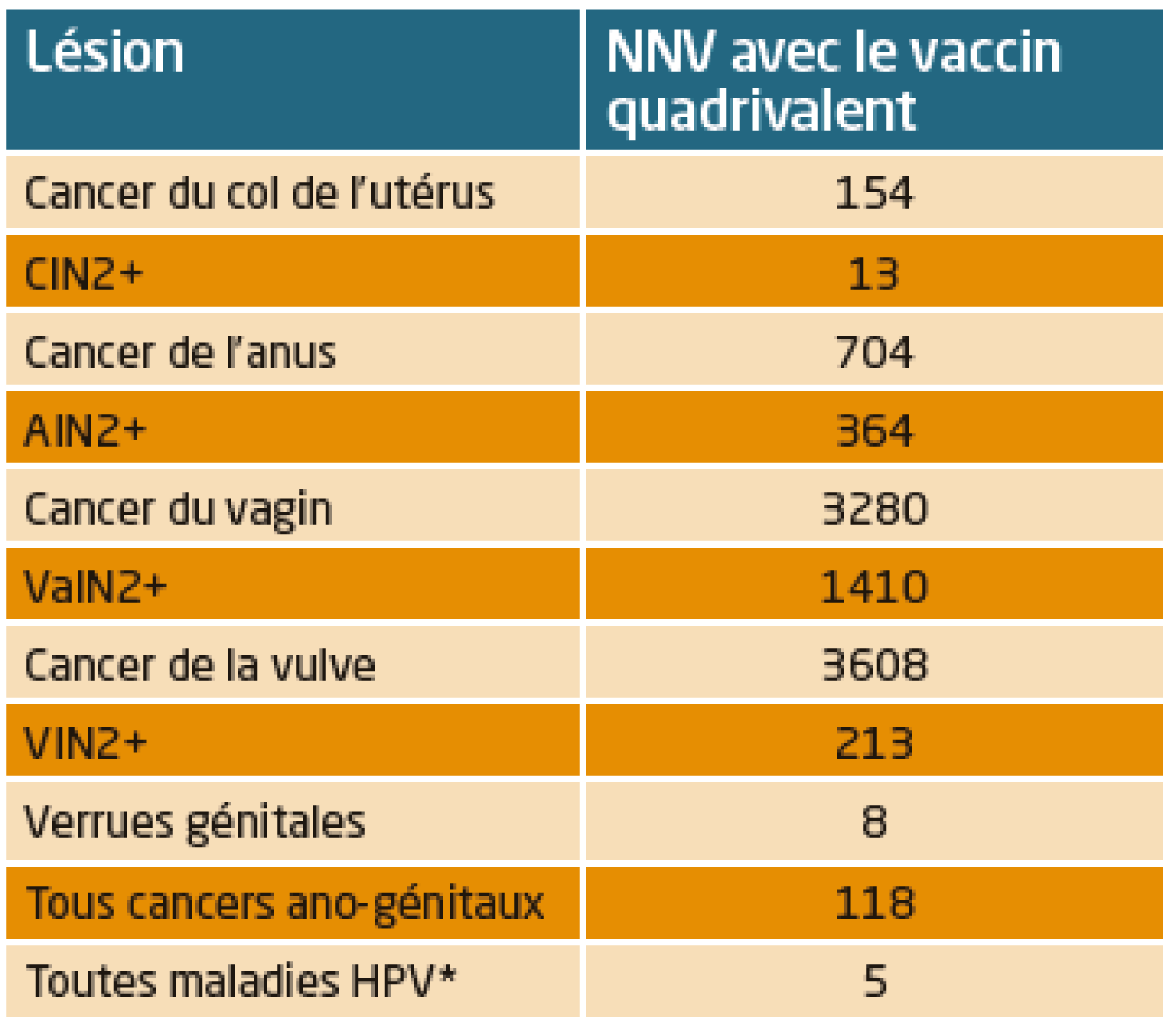
Tableau 1. Nombre nécessaire de jeunes filles à vacciner pour éviter un cas (d’après Soubeyrand B. ISPOR 2016).
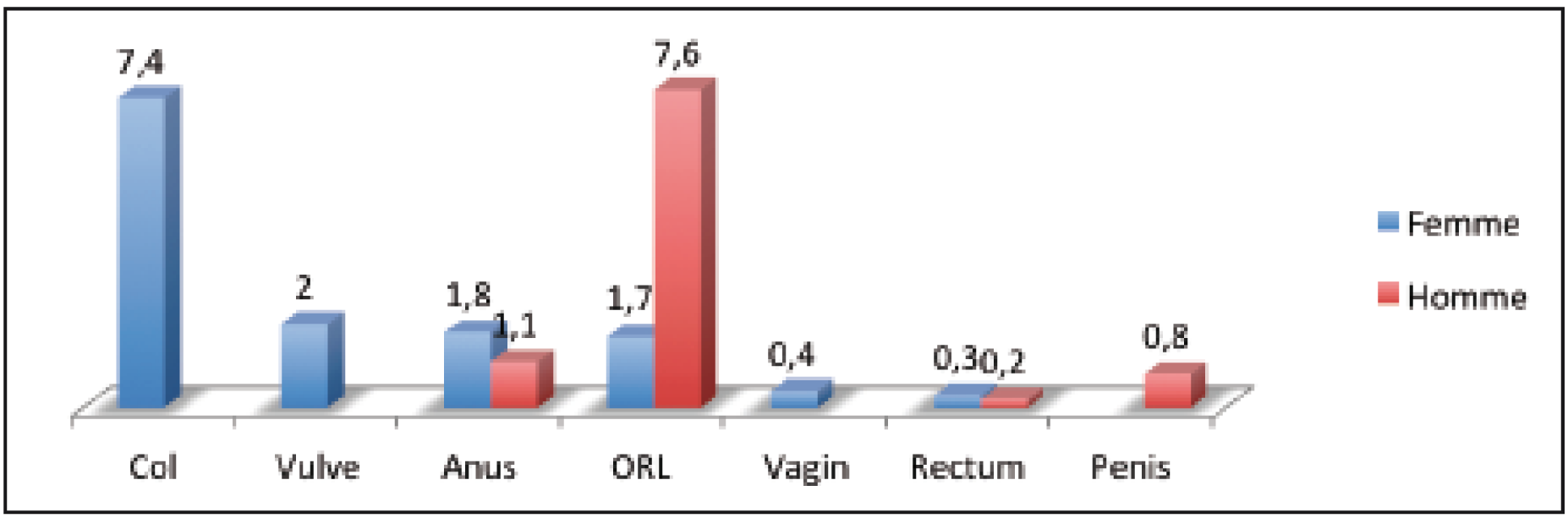
Figure 1 : Les cancers viro-induits / 100 000 sujets / an (4).
■ L’efficacité des vaccins est prouvée
Les premiers essais cliniques remontent à 1996, en octobre 2005 les essais de phase 3 confirment l’efficacité vaccinale qui s’étend au-delà de HPV 16 et 18 grâce à la protection croisée, l’AMM est obtenue en juin 2006 aux Etats-Unis et en septembre 2006 en France et en Europe, le remboursement est effectif en France en juillet 2007.
Le suivi des patientes incluses dans les essais de phase 3 se poursuit en Scandinavie avec l’absence de lésions cervicales pré malignes observées chez les vaccinées après 8 ans de suivi (et de même en Colombie après 6 ans de suivi). La comparaison des patientes finnoises vaccinées (n = 861) dans le cadre des phases 3 FUTURE (vaccin quadrivalent) aux patientes non vaccinées du registre des cancers finnois (n = 15 719) montre que chez les vaccinées sont observés 3 CIN3 et aucun cancer invasif du col contre 59 CIN3 et 3 cancers invasifs dans le bras contrôle.
Les études en population sont elles aussi éloquentes :
– les études d’impact (= avant – après vaccination) regroupées au sein d’une méta-analyse récente (5), indiquent que les infections à HPV 16 et 18 diminuent de 64 % (d’autant plus que la couverture vaccinale est large), sans remplacement de souche, avec protection des garçons grâce à l’immunité de troupeau dès lors que la couverture vaccinale des filles excède 50 %, et que l’incidence des CIN de haut grade et adénocarcinomes in situ chutait de 31 % chez les jeunes filles dans la tranche d’âge des vaccinées,
– une étude française récente confirme ces chiffres avec une prévalence de l’infection HPV 16 et 18 chez les vaccinées de 0,1 % contre 12,6 % des jeunes filles non vaccinées consultant dans un centre de diagnostic anonyme et gratuit (6),
– les études d’efficacité (vaccinées vs non vaccinées) mettent en évidence chez les vaccinées (n = 24 871) une chute de 47,5 % des lésions de haut grade (CIN et AIS) en Australie par rapport aux non-vaccinées (n = 14 085) (7), et de 73 % au Danemark (avec respectivement n = 247 313 vs 151 931) (8).
■ Vaccin n’est pas vaccination
La couverture vaccinale HPV est en chute libre en France et bien loin des objectifs de 70 % de couverture fixé par les autorités de santé : fin 2015 seulement moins de 20 % des jeunes filles avaient reçu au moins 1 dose vaccinale à 15 ans.
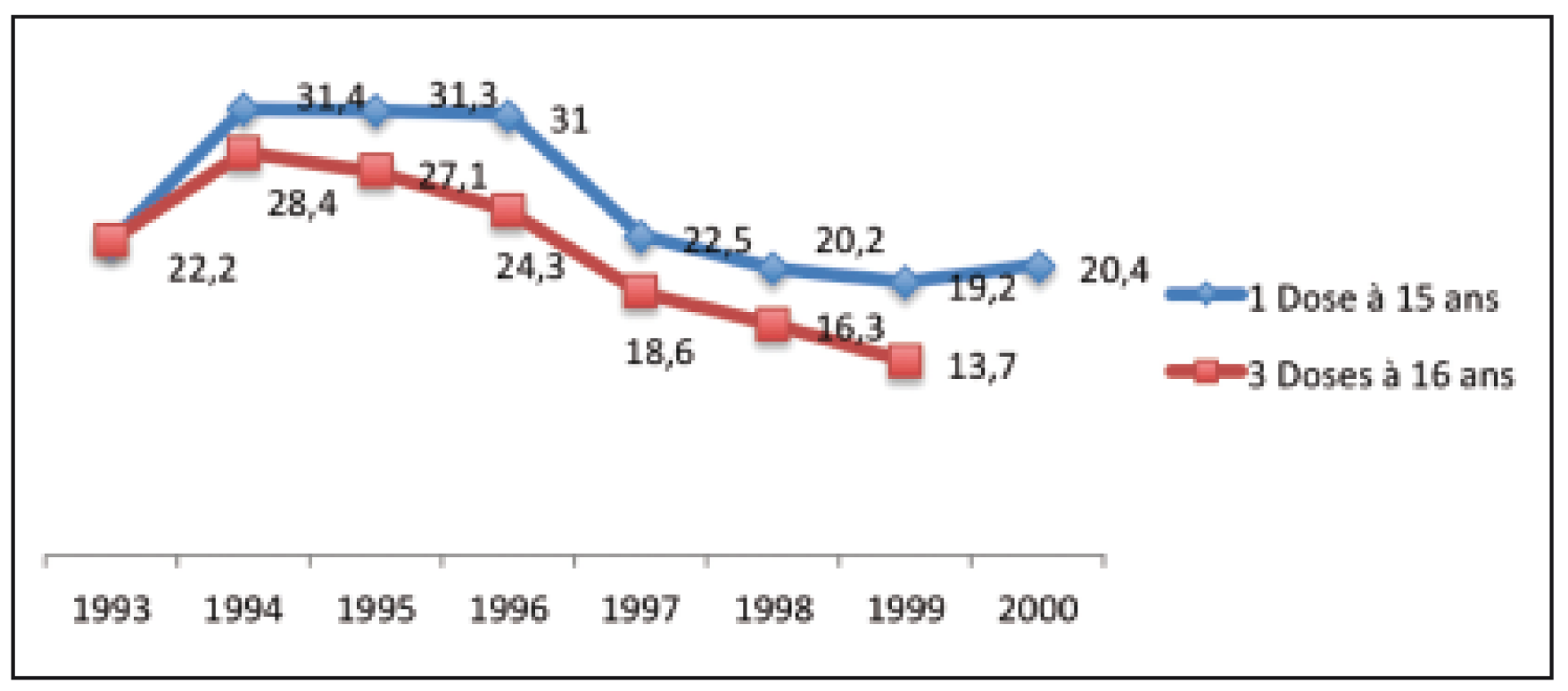
Figure 2. Couverture vaccinale en % par le vaccin HPV chez les jeunes filles selon leur année de naissance pour 1 et 3 doses le 31 décembre 2015 en France selon l’INVS.
On remarque que les taux de couverture vaccinale dans le monde sont disparates ce qui donne des pistes d’amélioration de notre couverture vaccinale :
– d’un côté, les pays vaccinant tôt et de manière organisée à l’école : les taux de couverture sont de 86 % au Royaume Uni, 76 % au Danemark, 71 % en Italie, 73 % en Espagne et 87 % au Portugal,
– de l’autre, les pays laissant à leurs citoyens l’initiative de la vaccination : France, Allemagne (40 %), Etats-Unis (41,9 % chez les filles avec à l’échelle du pays de fortes variations selon les états).
On notera que les différences culturelles interviennent peu (Europe du Nord et du Sud, Australie et les différents états américains), et qu’en réalité seule compte la politique vaccinale impulsée par les autorités de santé.
Une modélisation française met en lumière la perte de chance liée à cette médiocre couverture vaccinale : si l’on vaccinait 70 % de la population féminine, par rapport aux 17,2 % actuels, seraient épargnés : 1 300 cancers du col, 415 cancers de l’anus, 20 cancers vulvaires, 15 cancers du vagin et 660 vies seraient sauvées (9).
■ Pourquoi et que faire ?
De nombreux facteurs expliquent notre taux de couverture vaccinale insuffisante.
Le contexte socio-culturel pèse lourd puisqu’il est clairement établi que, épidémiologiquement, les populations les moins favorisées sont celles qui sont les plus exposées à l’HPV, qui bénéficient le moins du dépistage, et sont les moins vaccinées (10) : les autorités de santé françaises ont été attaquées sur leurs programmes de vaccination
(hépatite B, virus H1N1…), souvent injustement, ce qui peut expliquer leur réticence vis à vis d’une politique vaccinale « jacobine ».
La défiance du public vis à vis des effets secondaires supposés du vaccin est réelle (41 % des français doutent de la sécurité des vaccins) ; elle est sous tendue par l’exposition médiatique de syndromes complexes et nosologiquement mal cernés (Complex Regional Pain Syndrome en Australie, Japon, et Postural Orthostatic Tachycardia Syndrome aux Etats-Unis et Danemark), qui n’ont en réalité jamais pu être associés avec certitude à la vaccination.
Le public s’interroge de plus sur l’utilité du vaccin HPV : 61 % des mères étaient convaincues de l’intérêt du vaccin en 2008, elles ne sont plus que 36 % en 2015 ; ceci reste toutefois classique dans l’histoire de la vaccination : le vaccin est jugé indispensable lorsque la prévalence (réelle ou perçue) de la pathologie est importante, puis dénigré lorsque la pathologie est moins visible, ce d’autant que les effets secondaires sont alors moins supportés. Ces réactions du public sont largement alimentées par le travail médiatique des ligues anti-vaccinales qui agissent sur le public et les responsables médiatiques.
Deux études se sont intéressées en France éclairant la perception des mères et de leur filles :
– 38,1 % de 210 mères interrogées se sont déclarées hostiles à vacciner leurs filles de 14 à 18 ans principalement parce qu’elles estimaient que le vaccin était trop récent, et qu’elles craignaient les effets secondaires (11),
– sur 606 étudiantes toulousaines interrogées en 2010, 30,4 % n’étaient pas vaccinées par méconnaissance (56,5 %), peur des effets secondaires (21,5 %), et s’estimant non à risque (11 %) (12).
Enfin, les médecins eux-mêmes semblent douter de l’intérêt de la vaccination HPV : seulement 60 % des médecins français sont favorables à une vaccination HPV obligatoire contre 97 % d’entre eux concernant le vaccin ROR ou coquelucheux. Une enquête de l’Institut des Mamans commanditée par GSK met en lumière la baisse du conseil vaccinal chez les médecins : 72 % conseillaient une vaccination HPV en 2010, et ils ne sont plus que 61 % en 2015. Il faut y voir aussi une certaine lassitude du corps médical face à certaines patientes de plus en plus méfiantes voire revendicatrices, or les médecins, qui sont au contact direct de leur patientèle, sont de très loin les plus écoutés et suivis des professionnels de la santé.
■ Au total
Nous disposons d’études nombreuses et de haut niveau de preuve concernant l’efficacité des vaccins et leur sécurité.
Nous avons donc en tant que médecin, des arguments à faire valoir auprès de nos patientes, à présenter aux anti-vaccinaux, et devrions pouvoir bénéficier de l’appui des pouvoirs publics qui ont déjà soutenu la vaccination dans le domaine scientifique (cf la dernière somme française étudiant le risque de maladies auto-immunes chez 2,2 millions de jeunes françaises de 13 à 16 ans dont 840 000 avaient été vaccinées (13)), en particulier dans le champ médiatique.
Déclaration publique d’intérêts : Jean Levêque déclare être consultant pour les laboratoires Sanofi Pasteur MSD et GlaxoSmithKline en relation avec les vaccins prophylactiques HPV.
RÉFÉRENCES
1. http://inca.fr. 2013.
2. Monsonego J, Breugelmans JG, Bouee S, Lafuma A, Benard S, Remy V. Incidence, prise en charge et coût des condylomes acuminés anogénitaux chez les femmes consultant leur gynécologue en France. Gynecol Obstet Fertil 2007; 35: 107-113.
3. Bergeron C, Cohet C, Bouée S, Lorans C, Rémy V. Coût de la prise en charge des frottis anormaux et des béoplaises intraépithéliales du col de l’utérus en France. Bull Epidémiol Hebd 2007; 4-6.
4. Viens LJ, Henley SJ, Watson M, Markowitz LE, Thomas CC, Thompson TD et al. Human Papillomavirus-Associated Cancers – United States, 2008-2012. MMWR Morb Mortal Wkly Rep 2016; 65: 661-666.
5. Drolet M, Benard E, Boily MC, Ali H, Baandrup L, Bauer H et al. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis 2015; 15: 565-580.
6. Heard I, Tondeur L, Arowas L, Parent Du Chatelet I, Demazoin M, Falguieres M et al. [Not Available]. Med Mal Infect 2016; 46: 10-11.
7. Gertig DM, Brotherton JM, Budd AC, Drennan K, Chappell G, Saville AM. Impact of a population-based HPV vaccination program on cervical abnormalities: a data linkage study. BMC Med 2013; 11: 227.
8. Baldur-Felskov B, Dehlendorff C, Munk C, Kjaer SK. Early impact of human papillomavirus vaccination on cervical neoplasia–nationwide follow-up of young Danish women. J Natl Cancer Inst 2014; 106: djt460.
9. Uhart M, Dahlab A, Bresse X, Largeron N. Loss Of Opportunity Linked With The Suboptimal Coverage Rate Of Hpv Vaccination In France. Value Health 2015; 18: A462.
10. Brisson M, Drolet M, Malagon T. Inequalities in Human Papillomavirus (HPV)-associated cancers: implications for the success of HPV vaccination. J Natl Cancer Inst 2013; 105: 158-161.
11. Haesebaert J, Lutringer-Magnin D, Kalecinski J, Barone G, Jacquard AC, Regnier V et al. French women’s knowledge of and attitudes towards cervical cancer prevention and the acceptability of HPV vaccination among those with 14 – 18 year old daughters: a quantitative-qualitative study. BMC Public Health 2012; 12: 1034.
12. Mehu-Parant F, Rouzier R, Soulat JM, Parant O. Eligibility and willingness of first-year students entering university to participate in a HPV vaccination catch-up program. Eur J Obstet Gynecol Reprod Biol 2010; 148: 186-190.
13. http://ansm.sante.fr. Vaccins anti-HPV et risque de maladies autoimmunes : étude pharmacoépidémiologique. 2015.







24 commentaires