Pathologie HPV au cours de la grossesse
L’examen prénatal constitue une bonne occasion pour découvrir les manifestations de l’infection HPV chez la femme enceinte, qu’il s’agisse de lésions exophytiques vues à l’examen clinique ou de lésions cervicales infracliniques dépistées au frottis. Quel que soit le signe d’appel, la prise en charge diagnostique doit permettre d’apprécier la nature, le siège, l’extension des lésions et de rechercher l’existence d’infections associées.
Epidémiologie
La fréquence réelle de l’infection HPV pendant la grossesse est inconnue. Les chiffres de la littérature varient selon les caractéristiques des populations étudiées et la sensibilité de la méthode de détection virale utilisée. La prévalence des infections HPV pendant la grossesse varie selon les études de 5,5 à 65 % 1-4. Elle est nettement corrélée à l’âge des femmes et diminue significativement après 30 ans. Parmi les facteurs de risque associés à l’infection HPV durant la grossesse on note principalement le nombre élevé de partenaires sexuels, surtout avant l’âge de 20 ans et les antécédents de maladies sexuellement transmissibles 1. La prévalence des infections HPV pendant la grossesse est supérieure à celle observée dans la population en dehors de la grossesse probablement en raison de la diminution de la clairance de l’infection HPV observée dans les deux premiers trimestres de la grossesse 5, 6. Parallèlement la réplication virale est plus importante au début de la grossesse où le nombre de copies virales est près de 10 fois plus élevé que chez les femmes non enceintes, probablement favorisée par l’immuno-dépression gravidique et l’augmentation des hormones stéroïdes (progestérone et glucocorticoïde). Une diminution de la prévalence de l’infection HPV est observée au troisième trimestre de la grossesse. Elle semble davantage liée à des modifications du comportement sexuel (plus grande stabilité dans le couple et moindre fréquence de rapports sexuels) qu’à des modifications de déterminants biologiques de la persistance de l’infection 2.
Les co-infections sont fréquentes durant la grossesse, mais l’HPV de type 16 constitue l’infection la plus fréquente 7-9. Ce type est identifié seul ou associé à d’autres types dans plus d’un tiers des cas.
Transmission des HPV de la mère
à l’enfant
Dans une revue de la littérature basée sur 9 études prospectives incluant 2 111 femmes enceintes le risque moyen d’infection HPV, basé sur la détection du génome viral chez le nouveau-né, est de 6,5% (5,0 % – 8,0 %) variant selon les études de 1,5 % à 46,6 % 3. Une méta-analyse publiée en 2018 et basée sur 9 études, a rapporté un taux global de transmission intra-utérine d’HPV de 4,9 % (IC 95% 1,6-9,8). Néanmoins ces résultats doivent être interprétés avec prudence en raison d’une hétérogénéité entre les études prises en considération 10.
Inversement le risque de contamination de l’enfant, estimé à partir de la prévalence de l’infection maternelle, du nombre de naissance et de l’incidence des infections condylomateuses de l’enfant, est compris entre 1/80 et 1/1500. Cette apparente discordance s’explique par le fait que la grande majorité des infections néonatales ne sont que des portages transitoires sans conséquence clinique chez l’enfant.
Trois modes de transmission sont incriminés : la transmission in utero par voie transplacentaire, la transmission intrapartum par contact direct et la transmission postnatale. Ces différents modes de contamination peuvent être associés.
a) La transmission in utero
Les arguments en faveur de la transmission in utero sont la présence de condylomes acuminés congénitaux, l’existence de papillomatose respiratoire chez des enfants nés par césarienne et l’isolement d’ADN HPV dans le liquide amniotique de 15 à 65 % des gestantes présentant des lésions cervicales associées au papillomavirus. Une voie trans-placentaire ou trans-membranaire a été évoquée.
b) La transmission intrapartum
La contamination se fait par la transmission de virions ou de cellules épithéliales infectées par le contact direct du foetus avec la filière génitale maternelle infectée. Le taux de transmission est corrélé à la charge virale maternelle. Les arguments en faveur de ce mode de transmission sont la similitude des aspects histologiques et des types d’HPV dans les condylomes des mères et les papillomes des enfants, la présence fréquente d’ADN HPV dans l’aspiration naso-pharyngée ou dans les frottis buccaux ou génitaux réalisés dans les premiers jours de vie chez les nouveau-nés de mères infectées et la fréquence plus élevée d’infection HPV néonatale en cas d’accouchement par les voies naturelles par rapport à la césarienne (18,3 % versus 8 % ; RR = 1,8 ( 1,3 – 2,4) 3. Une récente méta-analyse, évaluant l’impact du mode d’accouchement sur la transmission verticale de l’HPV a confirmé ces résultats en rapportant des taux de transmission significativement plus faibles en cas de césarienne en comparaison à l’accouchement par voie vaginale (14,9 % versus 28,2%, RR = 0,5 ( 0,34 – 0,78) 11.
c) La transmission postnatale
Une contamination du nourrisson ou du jeune enfant par la mère ou par une autre personne infectée a été largement documentée. La discordance des types d’HPV détectés chez les enfants et leur mère qui est notée dans 31 % à 47 % des cas évoque d’autres sources de contamination 12. Elle se fait soit par un contact direct, soit par le linge ou des objets souillés voire au cours de l’allaitement. En eff et de l’ADN HPV a été détecté dans 4,5 à 19,7 % des échantillons de lait obtenus 3 jours à 2 mois après l’accouchement. Ce mode de transmission est difficile à quantifier, mais l’infection de l’enfant est près de cinq fois plus fréquente chez une mère porteuse d’une infection HPV six semaines après l’accouchement par rapport à une mère non infectée (27,3 versus 7,2 %) 1.
Diagnostic de l’infection HPV clinique
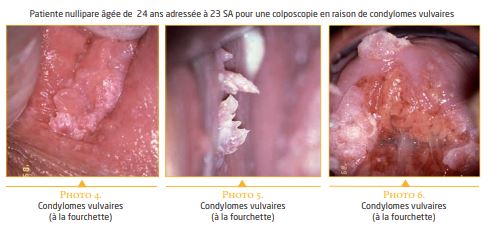
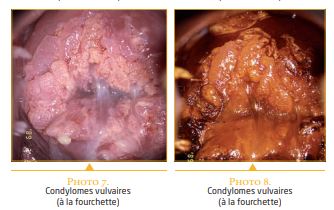
Pendant la grossesse, les manifestations de l’infection HPV sont identiques à celles observées chez la femme non enceinte. Les condylomes acuminés ne représentent que 6 % des infections HPV de la femme enceinte. Ces lésions sont fréquemment multifocales, elles concernent le col, le vagin, la vulve et l’anus. Les atteintes du revêtement cutané ano-génital et du revêtement muqueux de la vulve, du vagin et du col, se caractérisent par une tendance à l’extension et la prolifération au cours de la grossesse. Ces lésions exophytiques sont associées aux HPV de type 6, 11, 42, 43, 44. Elles sont généralement faciles à reconnaître, uniques ou multiples, isolées ou groupées, et de taille variable, allant du petit condylome acuminé, à des masses coalescentes importantes. La tendance à l’extension et l’hyperhémie tissulaire peuvent favoriser certaines complications maternelles : ulcération, hémorragie, surinfection et obstruction des voies génitales.
Prise en charge diagnostique et thérapeutique
a) Prise en charge diagnostique
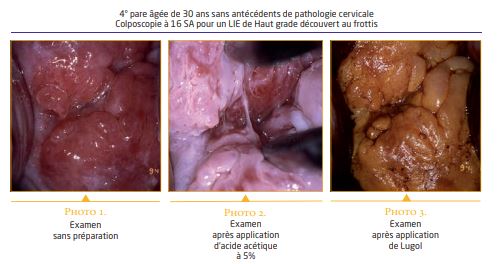
Quelle que soit leur localisation les lésions cliniques peuvent s’associer à une infection infraclinique voire latente. Ces lésions infracliniques associées sont fréquentes et doivent faire l’objet d’une évaluation cyto-colposcopique complète de toute la filière génitale basse. Elles se manifestent essentiellement dans la zone de transformation du col sous la forme d’une infection HPV pure (condylome plan) ou d’une néoplasie associée à l’HPV (CIN). Le frottis cervicovaginal constitue le moyen de dépistage habituel de ces lésions.
Le frottis cervical ne permet pas d’établir un diagnostic lésionnel précis. Les indications de la colposcopie sont les mêmes chez la femme enceinte et chez la femme non enceinte. La technique est
identique mais les manipulations risquent plus facilement de faire saigner les tissus hyperhémiés et congestifs. Les modifications physiologiques de la grossesse rendent l’interprétation colposcopique plus difficile. L’intensité de l’acidophilie et l’accentuation des anomalies vasculaires peuvent donner une impression de lésion plus sévère ou, à l’inverse, masquer certaines lésions. La grossesse ne constitue pas une contre-indication à la biopsie dirigée. Il est préférable d’utiliser des pinces plus petites, et parfaitement coupantes, pour ne pas provoquer de saignement abondant. La biopsie est particulièrement indiquée en cas de lésions étendues évoquant une CIN de haut grade ou une lésion invasive, et en cas d’anomalies colposcopiques équivoques ou douteuses 13.
Malgré l’importance des modifications gravidiques du col, la colposcopie reste un examen fi able chez la femme enceinte 14. La proportion de colposcopie satisfaisante est plus importante et augmente avec l’âge gestationnel. Grâce à la biopsie dirigée, la concordance du diagnostic au cours de la grossesse avec le diagnostic final du post partum atteint 85 % pour les CIN de bas grade et 90 % pour les CIN de haut grade. Cette fiabilité autorise la surveillance des CIN au cours de la grossesse et leur traitement approprié après l’accouchement. Elle évite le plus souvent le recours à une conisation diagnostique qui comporte davantage de complications chez la femme enceinte et est incomplète dans près de 50 % des cas 15. Les indications de la conisation pendant la grossesse devraient se limiter aux patientes avec un frottis évoquant un cancer dont la colposcopie non satisfaisante ne permet pas de voir la limite supérieure de la lésion et à celle dont la biopsie montre un carcinome micro-invasif ou un adénocarcinome in situ faisant craindre une lésion plus évoluée, c’est à dire invasive, en dehors du site de biopsie.
b) Prise en charge thérapeutique
En l’absence de traitement spécifique des papillomavirus, les objectifs du traitement de la femme enceinte sont davantage la prévention des complications symptomatiques maternelles que la réduction de la transmission de l’HPV au fœtus ou au nouveau-né.
Parmi les médicaments cytotoxiques, la Podophiline, le5 Flurouracil, la Bléomycine et l’Interféron sont contre indiqués pendant la grossesse. Pour les petites lésions isolées l’abstention thérapeutique est possible. Pour des condylomes acuminés plus importants, l’application d’acide trichloracétique peut être proposée. La vaporisation au laser CO2 peut être proposée pour les lésions condylomateuses extensives et résistantes. La période entre 32 et 34 semaines d’aménorrhée paraît
être un bon compromis pour éviter les récidives et obtenir une bonne cicatrisation avant le terme.
Pour les éventuelles CIN associées, il n’existe à l’heure actuelle aucun argument en faveur d’une évolution plus rapide au cours de la grossesse. Par conséquent le faible potentiel évolutif des CIN pendant la grossesse et la fiabilité de la colposcopie et de la biopsie dirigée, permettent dans la grande majorité des cas de surveiller les CIN pendant la grossesse et de différer le traitement 6 semaines à 6 mois après l’accouchement pour le réaliser dans de meilleures conditions en fonction des résultats d’une nouvelle réévaluation cyto-colpo-histologique 16,17. Ni l’infection HPV, ni les lésions induites par cette infection n’obèrent significativement le pronostic obstétrical 4.
Conclusion
La fréquence réelle de l’infection HPV pendant la grossesse est inconnue, mais semble supérieure à celle observée au même âge en dehors de la grossesse. En l’absence de traitement spécifique de l’infection à papillomavirus, le traitement vise d’une part à réduire le volume des lésions pour diminuer les complications maternelles et le risque de contamination intrapartum et d’autre part à éviter l’évolution d’une CIN vers le cancer invasif. Tout traitement doit être précédé d’un bilan pour apprécier la nature, le siège, l’extension des lésions et rechercher l’existence d’infections associées.
L’auteur déclare ne pas avoir de liens d’intérêt relatifs à cet article.
M. Lodi1, E. Faller1, T. Boisrame1, C-Y. Akladios1,3, J.-J. Baldauf,3
1Département de Gynécologie et d’Obstétrique ; Hôpital de Hautepierre ; Hôpitaux Universitaires de Strasbourg
2 I-Cube UMR 7357-Laboratoire des Sciences de L’ingénieur, de L’informatique et de L’imagerie, Université de Strasbourg
3 EA3181, Université de Franche-Comté, Université Bourgogne Franche-Comté, Besançon
RÉFÉRENCES
1 – Castellsague X, Drudis T, Canadas MP, Gonce A, Ros R, Perez JM, Quintana MJ, Munoz J, Albero G, de Sanjose S, Bosch FX. Human Papillomavirus (HPV) infection in pregnant women and mother-to-child transmission of genital HPV genotypes: a prospective study in Spain. BMC Infect Dis 2009;9: 74.
2 – Domza G, Gudleviciene Z, Didziapetriene J, Valuckas KP, Kazbariene B, Drasutiene G. Human papillomavirus infection in pregnant women. Arch Gynecol Obstet 2011;284: 1105-12.
3 – Medeiros LR, Ethur AB, Hilgert JB, Zanini RR, Berwanger O, Bozzetti MC, Mylius LC. Vertical transmission of the human papillomavirus: a systematic quantitative review. Cad Saude Publica 2005;21: 1006-15.
4 – J. Niyibizi, N. Zanr´e, M.-H. Mayrand, and H. Trottier, The association between adverse pregnancy outcomes andmaternal human papillomavirus infection:A systematic reviewprotocol. Systematic Reviews, vol. 6, no. 1, 2017.
5 – Fife KH, Katz BP, Brizendine EJ, Brown DR. Cervical human papillomavirus deoxyribonucleic acid persists throughout pregnancy and decreases in the postpartum period. Am J Obstet Gynecol 1999;180: 1110-4.
6 – Nobbenhuis MA, Helmerhorst TJ, van den Brule AJ, Rozendaal L, Bezemer PD, Voorhorst FJ, Meijer CJ. High-risk human papillomavirus clearance in pregnant women: trends for lower clearance during pregnancy with a catch-up postpartum. Br J Cancer 2002;87: 75-80.
7 – Aydin Y, Atis A, Tutuman T, Goker N. Prevalence of human papilloma virus infection in pregnant Turkish women compared with nonpregnant women. Eur J Gynaecol Oncol 2010;31: 72-4.
8 – Lu DW, Pirog EC, Zhu X, Wang HL, Pinto KR. Prevalence and typing of HPV DNA in atypical squamous cells in pregnant women. Acta Cytol 2003;47: 1008-16.
9 – Nowak Z, Karowicz-Bilińska A. [Human papilloma virus infection in pregnant women with normal pap-smears, HPV oncogenity and risk factors]. Ginekol Pol. 2007; 78(9): 678–684.
10 – Zouridis A, Kalampokas T, Panoulis K, Salakos N, Deligeoroglou E. Intrauterine HPV transmission: a systematic review of the literature. Arch Gynecol Obstet. 2018 Jul;298(1):35-44.
11 – Chatzistamatiou K, Sotiriadis A, Agorastos T. Effect of mode of delivery on vertical human papillomavirus transmission – A metaanalysis. J Obstet Gynaecol. 2016;36(1):10-4.
12 – Syrjanen S. Current concepts on human papillomavirus infections n children. APMIS 2010;118: 494-509.
13 – Wetta LA, Matthews KS, Kemper ML, Whitworth JM, Fain ET, Huh WK, Kendrick JE, Straughn JM, Jr. The management of cervical intraepithelial neoplasia during pregnancy: is colposcopy necessary? J Low Genit Tract Dis 2009;13: 182-5.
14 – Fader AN, Alward EK, Niederhauser A, Chirico C, Lesnock JL, Zwiesler DJ, Guido RS, Lofgren DJ, Gold MA, Moore KN. Cervical dysplasia in pregnancy: a multi-institutional evaluation. Am J Obstet Gynecol 2010;203: 113 e1-6.
15 – Frega A, Scirpa P, Corosu R, Verrico M, Scarciglia ML, Primieri MR, Palazzo A, Iacovelli R, Moscarini M. Clinical management and followup of squamous intraepithelial cervical lesions during pregnancy and postpartum. Anticancer Res 2007;27: 2743-6.
16 – Owens GL, Kitchener HC. Premalignant disease in the genital tract in pregnancy. Best Pract Res Clin Obstet Gynaecol. 2016 May;33:33-43.
17 – Mailath-Pokorny M, Schwameis R, Grimm C, Reinthaller A, Polterauer S. Natural history of cervical intraepithelial neoplasia in pregnancy: postpartum histo-pathologic outcome and review of the literature.BMC Pregnancy Childbirth. 2016 Apr 7;16:74.








26 commentaires