Mécanismes et enjeux de la vaccination durant la grossesse
1796 MARQUE UN TOURNANT DANS LA LUTTE CONTRE LES MALADIES INFECTIEUSES. EN EFFET, EDWARD JENNER, EN INOCULANT LA VACCINE, ZOONOSE BÉNIGNE TRANSMISE PAR LES BOVINS ET EQUIDÉS, PARVIENT À PROTÉGER L’HOMME CONTRE UN VIRUS PROCHE ET RESPONSABLE DE LA VARIOLE, POTENTIELLEMENT MORTELLE ET ENDÉMIQUE A CETTE EPOQUE. LES PROGRÈS DE LA VACCINATION ONT DEPUIS ÉTÉ CONSTANTS JUSQU’À L’AVÈNEMENT, À L’OCCASION DE LA PANDÉMIE COVID-19, DE NOUVEAUX VACCINS UTILISANT L’ARN MESSAGER (ARNm).
Qu’est-ce qu’un vaccin ?
L’objectif de la vaccination est double : collectif en limitant la propagation d’une maladie infectieuse et individuel en protégeant chaque individu vacciné contre la maladie et/ou ses formes sévères. La vaccination de masse a permis d’éliminer la variole à l’échelle mondiale et la poliomyélite, la rougeole et la rubéole dans plusieurs régions du monde. Selon l’OMS, la vaccination permettrait d’éviter chaque année de 3,5 à 5 millions de morts par an dans le monde1. Il s’agit donc d’un enjeu majeur de santé publique. Un vaccin est une préparation capable d’induire chez le sujet une réponse immunitaire spécifique et durable afin de le protéger, en cas d’exposition au pathogène, contre l’infection ou d’en atténuer ses conséquences. Pour fonctionner, un vaccin doit contenir un antigène (pathogène, protéine de surface, toxines…) ou une portion de son génome (ARNm) qui sera capable de déclencher la réponse immunitaire adaptée. Certains vaccins contiennent en plus un adjuvant. Cet adjuvant est une substance (le plus souvent des sels d’aluminium) ajoutée à la préparation vaccinale en vue :
– D’améliorer l’efficacité de la réponse immunitaire pour que celle-ci soit mieux préparée à combattre l’agent pathogène en cas d’exposition ultérieure ;
– De réduire la quantité d’antigènes dans le vaccin tout en maintenant une réponse immunitaire robuste ;
– De prolonger la durée de protection induite par le vaccin. Les adjuvants sont particulièrement évalués pour assurer leur sécurité et leur efficacité avant d’être inclus dans un vaccin.
Les premiers vaccins étaient composés d’un agent infectieux vivant dont le pouvoir pathogène avait été atténué mais qui était encore capable d’induire une stimulation du système immunitaire à l’origine d’une réponse suffisante pour protéger des effets d’un contact avec l’agent infectieux sauvage et durable. Une ou deux doses suffisent et les rappels et adjuvants ne sont en général pas nécessaires2. L’avantage, qui est aussi leur principal inconvénient, c’est leur capacité réplicative ce qui contre-indique leur utilisation en cas d’immunodépression ou de grossesse. Par ailleurs, il existe un risque très faible
de réversion vers la virulence. Bien que toujours utilisés aujourd’hui (vaccin ROR ou BCG par exemples), l’évolution des connaissances en immunologie, biologie et génétique et les progrès techniques ont permis de mettre au point de nouvelles approches vaccinales3,4 : vaccins inactivés, protéiques ou à ARNm.
Dans les vaccins inactivés, l’agent pathogène est complètement neutralisé (inactivation thermique ou chimique) et a perdu sa capacité de se répliquer. Il conserve néanmoins sa structure et peut donc être reconnu par le système immunitaire. La réponse immunitaire résultante est moins intense qu’avec un vaccin vivant. L’ajout d’un adjuvant pour renforcer l’immunogénicité est souvent nécessaire pour obtenir une réponse immunitaire suffisante4 ainsi que des rappels vaccinaux pour observer une réponse durable.
Les vaccins protéiques sont développés à partir d’une sous unité immunogène (protéine de surface, polysaccharide) du micro-organisme ou d’une toxine pathogène produite par la bactérie mais inactivée. La réponse immunitaire qu’il induit est peu intense nécessitant le plus souvent l’adjonction d’un adjuvant, plusieurs doses et des rappels. Les vaccins à ARNm sont une nouvelle approche qui utilise l’information génétique pour stimuler la réponse immunitaire contre un pathogène spécifique. Son développement débute par l’identification de l’antigène le plus immunogène, c’est à dire la partie du micro-organisme
la plus susceptible d’induire une réponse immunitaire protectrice. Après séquençage de cet antigène, une copie synthétique de l’ARNm correspondant est synthétisée en laboratoire puis encapsulée dans des lipides pour former des nanoparticules permettant de le protéger et de faciliter son entrée dans les cellules humaines. Une fois administrées, les cellules humaines sont capables de traduire cet ARNm pour produire la protéine d’intérêt qui va elle-même stimuler le système immunitaire. Ces vaccins ne contiennent en général pas d’adjuvants. Cependant, il est important de noter que l’ARNm ne reste pas longtemps dans le corps, et les cellules n’adoptent pas la capacité de produire l’antigène de manière permanente. Ce type de vaccin nécessite donc des rappels.
MÉCANISMES DE L’IMMUNISATION
• L’immunisation spécifique
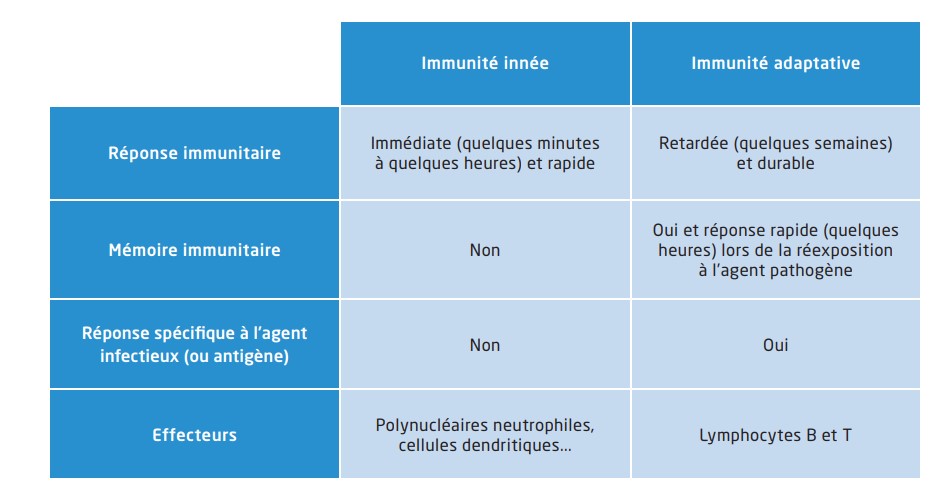
Lorsqu’un agent infectieux (virus, bactérie, parasite, champignon…) pénètre dans l’organisme, le système immunitaire est stimulé dans un objectif de protection. On distingue deux axes immunitaires. L’immunité innée correspond à une première ligne de défense, présente dès la naissance et dont la réponse est stéréotypée quel que soit le type d’agression, alors que l’immunité adaptative assure une réponse spécifique et durable (mémoire immunitaire) visà-vis de l’agent infectieux grâce à une maturation de son immunocompétence. Les principales caractéristiques des deux axes immunitaires sont résumées ci-dessous5 :
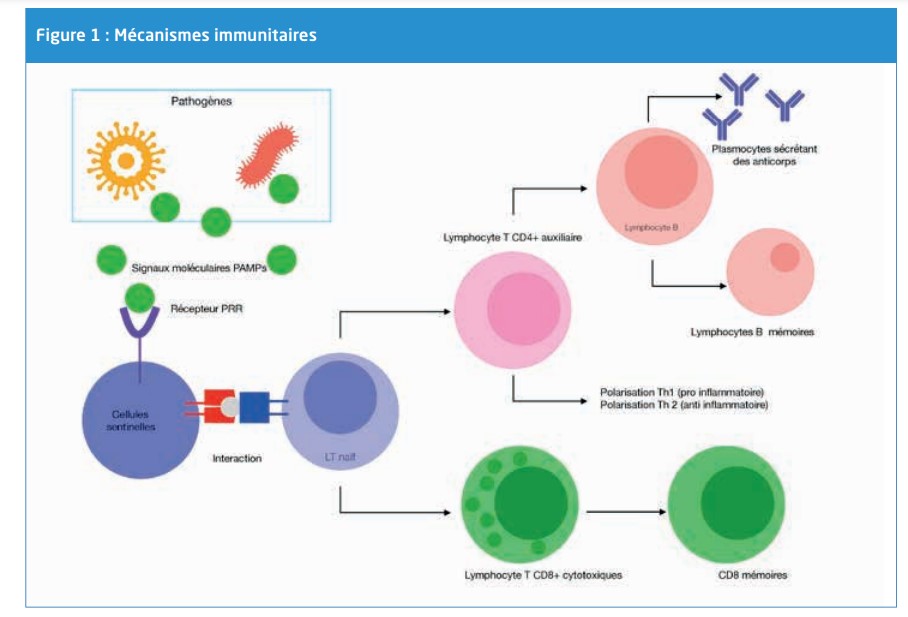
La réponse immunitaire résulte d’une interaction entre les cellules sentinelles (cellules dendritiques macrophages, mastocytes) présentent dans les tissus et les agents pathogènes : en cas d’agression, les récepteurs membranaires des cellules sentinelles, les PRR (Pattern Recognition Receptors), reconnaissent les PAMPs (Pathogen Associated Molecular Patterns ou Motifs Moléculaires Associés aux Pathogènes) qui sont des structures moléculaires portées par tous les micro-organismes et qui se comportent comme des signaux indicateurs de la présence d’un agent étranger6. Cette interaction déclenche plusieurs cascades de signalisation qui conduisent à une réponse inflammatoire avec phagocytose de l’agent pathogène puis l’initiation de la réponse immunitaire adaptative. En effet, suite à la phagocytose, c’est-à-dire la destruction du pathogène par les cellules immunitaires, les cellules sentinelles deviennent matures et migrent vers les organes lymphoïdes pour activer les lymphocytes T naïfs7. Selon le type de signal déclenché, les lymphocytes T se différentient en lymphocytes CD8 cytotoxiques (capables de détruire une cellule infectée) ou en lymphocytes CD4 auxiliaires8,9. Parmi la population de CD8 activés, la majorité meurt par apoptose après destruction de l’antigène. La minorité qui survit se différencie en CD8 mémoires spécifiques de l’antigène capables de persister toute la vie d’un individu. Une fois activés et selon l’environnement cytokinique, les CD4 activés subissent une polarisation en Th1 ou Th2. Les cellules Th1 sécrètent des cytokines pro-inflammatoires, telles que INF-χ et IL2, leur permettant d’être actifs dans la destruction des virus et bactéries intra-cellulaires. Les cellules Th2 sécrètent essentiellement des cytokines anti-inflammatoires (IL-4 principalement), qui régulent la
production d’anticorps10,11. En plus de cette réponse cellulaire médiée par les lymphocytes T, il existe une réponse humorale médiée par les lymphocytes B. Un lymphocyte B naïf peut capturer un antigène et s’activer indépendamment d’une interaction avec les lymphocytes T CD4. La réponse immunitaire induite est alors de faible intensité avec sécrétion d’IgM et sans génération de cellules mémoires12,13. Toutefois, la majorité des lymphocytes B coopèrent avec les lymphocytes CD4. Cette interaction permet de produire des immunoglobulines de type IgG (plasmocytes), de moduler l’affinité des IgG pour l’antigène, et de générer des lymphocytes B mémoires spécifiques de l’antigène et capables de persister toute la vie d’un individu16. (Figure 1)
Lors d’une réintroduction de l’antigène (infection naturelle ou rappel vaccinal), la stimulation des lymphocytes mémoires est à l’origine d’une réponse spécifique plus rapide, plus intense et durable9. Dans le cas de la vaccination, c’est la réponse immunitaire adaptative qui est ciblée. Lors de l’administration d’un vaccin, les cellules sentinelles s’activent et déclenchent une réponse immunitaire. Les adjuvants vaccinaux fonctionnent en imitant des PAMPs permettant de stimuler davantage le système immunitaire, renforçant ainsi la réponse immunitaire à l’antigène du vaccin.
• L’immunisation passive
Dans certaines situations d’urgence, si l’on souhaite bénéfi cier très rapidement d’une immunité spécifi que chez un individu non immunisé au préalable, on peut avoir recours à des préparations d’immunoglobulines. Ces produits dérivés du sang sont obtenus à partir du mélange de plasma de multiples donneurs et peuvent être concentrés en anticorps spécifi ques dirigés contre certains agents pathogènes. En cours de grossesse ils sont notamment utilisés pour conférer une protection immédiate contre le virus de la varicelle et du zona (VZV) chez une femme exposée non immunisée. On utilise aussi des immunoglobulines anti-virus de l’hépatite B (VHB) pour immuniser rapidement les nouveau-nés nés de mères ayant une infection active au VHB. La demi-vie de ces anticorps dans l’organisme est en général de quelques semaines et leur eff et protecteur ne persiste donc pas au-delà de quelques semaines/mois.
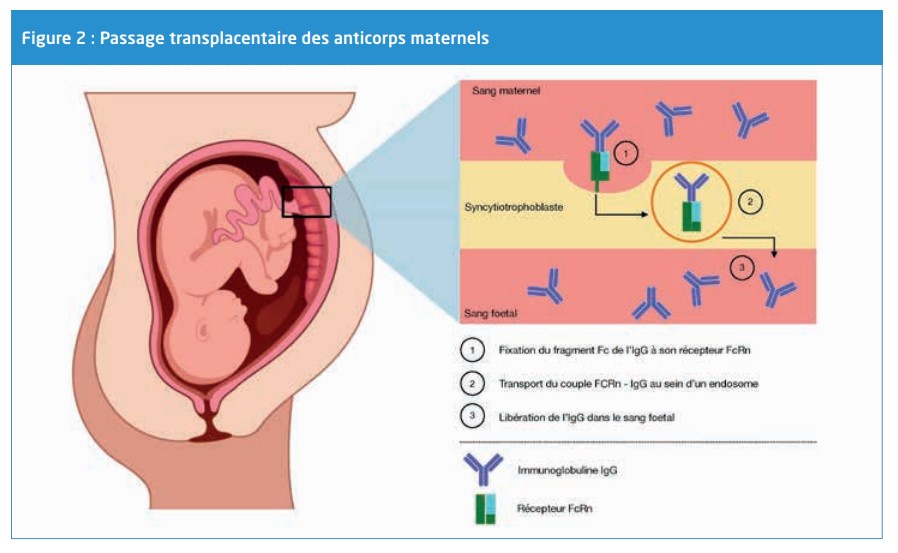
Les nouveau-nés bénéfi cient également d’une immunité passive grâce au passage transplacentaire des anticorps maternels. Organe transitoire mais essentiel durant la grossesse, le placenta constitue une interface d’échange entre la mère et le fœtus. Le placenta est un organe vascularisé qui relie le fœtus à l’utérus maternel. Chez l’homme le placenta est hémochorial, ce qui signifi e que le chorion baigne directement dans le sang maternel bien que les circulations maternelle et fœtale ne se mélangent jamais. En eff et, une barrière histologique constituée de 2 membranes : le syncytiotrophoblaste et les cellules endothéliales des capillaires fœtaux séparent le sang maternel du sang fœtal. Le placenta relie le fœtus à sa mère et accomplit de nombreuses fonctions que le fœtus est incapable d’accomplir par lui-même. Le placenta assume six principales fonctions : respiration, nutrition, élimination, protection, fonction endocrine, immunité14. Les échanges materno-fœtaux sont assurés par diff érents mécanismes de transfert tels que la diff usion, le gradient électrochimique ou via des transporteurs spécifi ques15,16. Le transport des IgG maternelles à travers la barrière placentaire, malgré leur faible poids moléculaire de 160kDa, fait appel à un mécanisme actif17. Des cinq classes d’immunoglobulines humaines, les IgG sont les seules à être transférées au fœtus via le placenta en quantité signifi cative et ce processus débute aux environs de la 13ème semaine de gestation, augmentant au cours de la grossesse et s’accélérant, en particulier, au 3ème trimestre de la grossesse18. Ce transfert s’opère par pinocytose grâce au fragment Fc des immunoglobulines et son récepteur néonatal (neonatal Fc Receptor) au niveau du syncytiotrophoblaste. L’immunoglobuline via son fragment Fc et son récepteur sont internalisés dans un endosome qui assure son transport jusqu’à la face fœtale du placenta19–24 (Figure 2).
Divers facteurs sont connus comme pouvant affecter le passage transplacentaire des anticorps maternels
– La sous-classe des IgG : ce sont les IgG1 qui traversent préférentiellement le placenta tandis que les IgG2 semblent être celles dont la transmission est la plus faible25,26. Cette différence pourrait avoir des conséquences sur la transmission des anticorps post-vaccination. En eff et, les IgG2 sont essentielles à l’opsonisation et la destruction des microorganismes possédant une capsule polysaccharidique et sont induites par les vaccins polysaccharidiques (Haemophilus infl uenzae b et Neisseria meningitidis)26, alors que les vaccins contenant des protéines antigéniques (tétanos) induisent de façon prédominante le transfert des IgG1 et IgG3.
– La glycosylation du fragment Fc des IgG : la liaison des IgGà ses récepteurs est influencée par sa glycosylation et il existe de nombreux variants de cette glycosylation27,28. La grossesse et/ou une infection intercurrente peuvent exercer une influence sur cette glycosylation29,30. Il est probable que la qualité plutôt que la quantité de la glycosylation soit déterminante pour le passage transplacentaire. En outre, le rôle de la vaccination en cours de grossesse sur la glycosylation n’est pas encore réellement compris.
– Le titre des anticorps maternels : il est bien établi que le titre des anticorps maternels joue un rôle déterminant dans l’efficacité de la transmission transplacentaire. En
général, les taux d’anticorps néonataux corrèlent avec les anticorps maternels, bien qu’au-delà d’un certain seuil d’IgG maternelles totales (> 15 g/L), les récepteurs des
fragments Fc pourraient être saturés. Il existerait alors une compétition entre les différents anticorps maternels et le ratio de transfert des IgG pourrait être de ce fait réduit lorsque le dosage pondéral des IgG est élevé.
– Une infection maternelle intercurrente : il est connu qu’une infection chronique maternelle réduit le transfert transplacentaire des IgG dont celles dirigées contre le Virus Respiratoire Syncitial (VRS), le virus de la rougeole, la bactérie responsable du tétanos, le virus de rubéole et l’Haemophilus infl uenzae B31–34. La majorité de ces études s’est focalisée sur l’infection à VIH et le paludisme maternel.
Les mécanismes pouvant expliquer ce phénomène sont encore méconnus et controversés31,35. Cette réduction pourrait être due à l’inflammation maternelle/placentaire, à l’hypergammaglobulinémie induite conduisant à la saturation des récepteurs Fc des IgG ou encore à une modification des profils de glycosylation induite par une infection chronique36,37.
– Une pathologie maternelle chronique ou aiguë : une malnutrition maternelle induit une réduction du ratio de transfert des IgG maternelles mais celle-ci pourrait être due à des différences de poids, morphologie ou vascularisation du placenta38–41. De même, un diabète maternel préexistant ou gestationnel via l’hyperglycémie maternelle, induirait une augmentation du transfert transplacentaire des anticorps42. Enfin, l’hypertension maternelle est associée à une augmentation des IgG ce qui peut paraître paradoxal dans la mesure où des dommages placentaires sont observés chez les patientes43.
– L’âge gestationnel et le poids de naissance : le transfert transplacentaire des IgG est exponentiel avec l’avancée de la grossesse avec un minimum au 1er trimestre puis une augmentation de 10% à 50% entre 17-22 SA et 28- 32 SA18,19. Au 3ème trimestre, ce ratio de transfert continue d’augmenter en particulier à partir de 36 SA : les titres d’IgG fœtaux auront doublé entre 28 et 41 SA et sont susceptibles d’excéder de 20 à 30% les titres maternels à la naissance44–46. Le transfert est donc significativement plus faible chez les enfants nés prématurément ce qui pose question sur le moment optimal d’une vaccination éventuelle en cours de grossesse45,47–50. En effet, une vaccination précoce serait plus profitable aux nouveaunés prématurés tandis qu’une vaccination plus tardive, correspondant au moment où le passage des anticorps maternels est plus importante, serait plus bénéfique aux nouveau-nés, nés à terme. Quoi qu’il en soit, les enfants prématurés étant plus à risque de développer des formes sévères d’infections acquises en période néonatale, la stratégie optimale serait un compromis entre la protection optimale des enfants nés à terme versus la protection de tout nouveau-né, né vivant.

POURQUOI VACCINER PENDANT LA GROSSESSE ?
La vaccination en cours de grossesse est une pratique de plus en plus répandue dont les objectifs sont doubles51 :
• Protéger la patiente en particulier s’il s’agit d’une infection présentant une morbidité accrue lorsqu’elle survient chez la femme enceinte (grippe, Covid…)
• Protéger le nouveau-né dès la naissance d’infections potentiellement sévères (coqueluche)
Protéger la femme enceinte
La grossesse s’apparente à une greff e semi allogénique : 50% d’origine maternelle (soi) et 50% d’origine paternelle (non soi). Un phénomène d’immuno-modulation est nécessaire pour tolérer la grossesse et éviter un rejet. Au niveau placentaire, cette tolérance est assurée par l’expression de molécules qui inhibent l’action cytolytique des cellules cytotoxiques contre les cellules trophoblastiques52,53. Au niveau systémique, l’environnement hormonal influe sur l’immunité : des taux élevés d’œstrogènes, comme ceux observé pendant la grossesse, favorisent la production de cellules Th2 au dépend des cellules Th1. On observe ainsi un shift de la polarisation lymphocytaires (Th2 > Th1) à
l’origine d’une plus grande susceptibilité aux infections virales ou bactériennes10,52. Ainsi, ce shift immunitaire et les modifications cardio-respiratoires observées pendant
la grossesse sont associées à une morbi-mortalité plus importante notamment en cas d’infections respiratoires.
Protéger le nouveau-né
À la naissance, les nouveau-nés sont confrontés à de multiples micro-organismes auxquels ils sont particulièrement vulnérables compte-tenu de l’immaturité et du caractère naïf de leur système immunitaire. Selon l’OMS, en 2019, 2,4 millions de nouveau-nés sont décédés au cours de leurs premiers de mois de vie principalement de cause infectieuse55. Le transfert transplacentaire passif des anticorps de la mère à son fœtus
est donc primordial pour lui conférer une immunité dans les premières semaines et premiers mois de vie. La vaccination en cours de grossesse est une des stratégies retenues, qui a pour objectif de protéger l’enfant en augmentant la concentration
des anticorps induits par la vaccination et donc la quantité de ces anticorps pouvant être transférée de la mère à son fœtus. Ce transfert d’une immunité passive au nouveau-né
permet de le protéger des infections qu’il pourrait contracter avant sa propre vaccination, ou le temps que cette période de vulnérabilité immunologique soit révolue.
VACCINER PENDANT LA GROSSESSE EN PRATIQUE
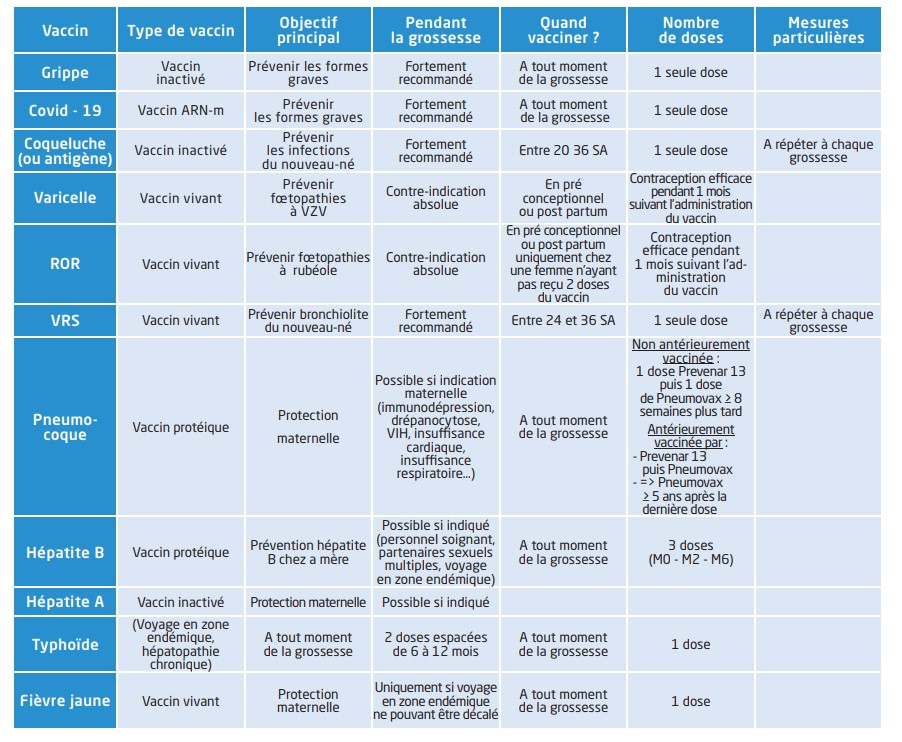
A l’heure actuelle, 3 vaccins sont formellement recommandés chez la femme enceinte : le vaccin antigrippal, le vaccin antin-COVID-19 et celui contre la coqueluche mais d’autres (hépatite B ou pneumocoque, fièvre jaune par exemple) sont possibles selon les facteurs de risque de la patiente56,57.
• Quels vaccins prescrire ?
– Vaccins vivants atténués
En raison de leur pouvoir pathogène conservé, mais atténué, les vaccins vivants présentent un risque d’infection maternelle avec une virémie et un potentiel passage transplacentaire pouvant être à l’origine d’une fœtopathie infectieuse. En raison de ce risque théorique, ces vaccins sont actuellement contre indiqués chez les femmes enceintes58. Toute vaccination par un vaccin vivant chez une femme en âge de procréer doit être administrée après avoir éliminé une grossesse en cours et tout projet de grossesse doit être diff éré d’au moins un mois après la vaccination59. Il existe une exception pour le vaccin contre la fi èvre jaune. IL s’agit d’une arbovirose endémique dans certaines régions d’Afrique et d’Amérique du Sud et qui se transmet à l’homme via une piqure de moustique. Elle est responsable de plusieurs dizaines de milliers de décès en zones endémiques60. La prévention la plus effi cace repose sur l’administration d’une dose de vaccin vivant atténué. Si un voyage en zone à risque ne peut être diff éré pendant une grossesse, l’administration du vaccin reste possible.
– Vaccins inactivés
L’administration de tous les vaccins inactivés est possible quel que soit le terme de grossesse et les données sur leur sécurité sont rassurantes. En pratique, les principaux vaccins administrés en cours de grossesse sont le vaccin antigrippal et le vaccin anti-coqueluche.
Vaccin anti grippal :
La grippe est une infection respiratoire virale épidémique en hiver provoquée par des virus à ARN de la famille des orthomyxovirus. La grossesse est un facteur de risque de morbi mortalité plus importante en cas d’infection grippale avec un risque d’hospitalisation pour complication cardiopulmonaire multiplié par 561.C’est également un facteur de risque de fausse couche, de prématurité et de retard de croissance62. Il a fallu attendre la pandémie de grippe H1N1 de 2009 et le rapport de 2012 du Haut conseil de la Santé Publique pour que la France recommande la vaccination antigrippale chez toute femme quel que soit l’âge gestationnel 63. Toutefois, entre 2019 et 2021, seulement 1 femme sur 5 (21,1 %) s’était faite vacciner pendant sa grossesse, bien loin de l’objectif de 75 % fixé par les autorités de santé. Par ailleurs, seulement 36,9% déclaraient avoir été informées par leur médecin ou sage-femme de la possibilité de cette vaccination.64 Les vaccins disponibles sont des vaccins inactivés tétravalents (Fluarix Tetra, Vaxigrip Tetra, Infl uvac Tetra) administrés par voie intra musculaire. Les données disponibles sur la sécurité du vaccin en cours de grossesse et chez le fœtus/ nouveau-né sont rassurantes. Ainsi toute femme enceinte doit être vaccinée contre la grippe et ce quel que soit l’âge gestationnel65,66.
Vaccin anti-coqueluche :
La coqueluche est une infection respiratoire d’origine bactérienne causée par Bortella pertussis. Elle se manifeste essentiellement par des quintes de toux plus ou moins rapprochées et intenses pouvant aboutir à des épisodes de cyanose et parfois au décès. Les nourrissons de moins de six mois représentent 90 % des décès dus à la coqueluche et constituent donc une population particulièrement vulnérable56. La vaccination anti-coqueluche ne débutant qu’à partir de 2 mois en France, une immunité passive optimale est un complément essentiel pour protéger les nourrissons. Jusque récemment, la protection des nouveau-nés reposait exclusivement sur la stratégie du cocooning, c’est à dire la vaccination de l’entourage proche d’un nouveau-né (parents, fratrie, grands-parents…)67. En 2022, la Haute Autorité de Santé (HAS) a publié de nouvelles recommandations encourageant la vaccination anti-coqueluche pendant la grossesse entre 20 et 32 SA et ce à chaque grossesse56. Le vaccin utilisé est un vaccin tétravalent combiné au Tétanos, à la Poliomyélite et à la Diphtérie (Boostrix tétra® ou Repevax®) ce qui ne pose pas de problème. Il n’existe pas de vaccin monovalent anti-coqueluche en France.
– Vaccins à ARNm
Les vaccins à ARNm sont relativement récents et principalement représentés par les vaccins anti SARSCoV-2. Si la grossesse ne semble pas augmenter le risque d’infection par le SARS-CoV-2, l’évolution et les complications d’une infection sont majorées68. En effet, l’infection par le SARS-CoV-2 en per partum est associée à un surrisque d’hospitalisation en réanimation, d’intubation et de mortalité maternelle69,70. Sur le plan fœtal, le COVID-19 est associé à davantage de pré-éclampsie, d’hypertension gravidique, d’accouchement prématuré, d’hémorragie du post partum et de mortinatalité71. Actuellement, les différentes sociétés savantes recommandent la vaccination contre le COVID-19 chez la femme enceinte en France72, comme dans le monde73,74. En France les vaccins à ARNm Comirnarty® et Spikevax® sont autorisés chez la femme enceinte. Les données sur leur sécurité sont rassurantes sur le déroulement de la grossesse et l’issue néonatale75. La vaccination contre le COVID-19 pendant la grossesse permet de diminuer les taux de décès néonataux, de morbidité néonatale sévère et d’admission en réanimation néonatale76.
• Qui peut prescrire ?
Depuis août 2023, les professionnels de santé pouvant prescrire des vaccins ne se limitent plus aux médecins. En effet, la modification des articles R.4311-5-1, R.5125- 33-8-I, R.5126-0-1.-l et D-4151-25 élargit les compétences de prescription et administration de vaccins aux pharmaciens, infirmiers diplômés d’état77 et aux sages-femmes78.
• Y-a-t-il des inconvénients à vacciner en cours de grossesse ?
La vaccination pendant la grossesse est généralement considérée comme sûre et bénéfique, mais comme pour tout acte médical, il y a des considérations à prendre en compte :
– Réaction locale ou systémique : il peut y avoir des réactions locales au site d’injection (rougeur, douleur) ou des réactions systémiques (fi èvre, malaise). Cependant, ces réactions ne sont pas plus fréquentes chez la femme enceinte et sont généralement légères et temporaires.
– Réactions allergiques : les réactions allergiques graves aux vaccins sont extrêmement rares. Les vaccins recommandés pendant la grossesse sont conçus pour être sûrs, mais toute réaction inhabituelle doit être signalée à un professionnel de santé.
– Date de vaccination : Certains vaccins sont recommandés à des moments spécifiques de la grossesse. Il est essentiel
de suivre les recommandations médicales pour en assurer l’efficacité et la sécurité.
– Consultation médicale : Il est toujours recommandé de discuter avec un professionnel de la santé avant de prendre des décisions sur la vaccination pendant la grossesse. Chaque grossesse est unique, et les recommandations peuvent varier en fonction de la santé de la femme enceinte.
La vaccination maternelle peut aff ecter la réponse immunitaire chez le nourrisson d’une manière complexe. Dans certains cas, la vaccination maternelle peut potentiellement avoir un eff et d’atténuation ou de « blunting » de la réponse immunitaire chez le nourrisson par rapport à une vaccination postnatale (après la naissance). L’eff et de « blunting » peut dépendre du type de vaccin, de la maladie ciblée et de divers facteurs immunologiques. Parfois, les anticorps transmis de la mère au fœtus pendant la grossesse peuvent neutraliser les vaccins administrés au nourrisson, réduisant ainsi l’effi cacité de la vaccination chez le bébé. Cela peut être particulièrement pertinent dans le contexte de certains vaccins, tels que ceux administrés dans les premiers mois de la vie. Dans le cadre de la recommandation sur la vaccination coqueluche, la HAS s’est interrogée sur l’eff et blunting de cette stratégie. L’eff et inhibiteur des anticorps maternels sur la production d’anticorps par le nourrisson est eff ectivement décrit, mais ses conséquences sur la protection à terme des nourrissons primo-vaccinés n’est pas déterminée et il n’y a pas de preuve solide indiquant que les vaccins maternels provoquent un eff et de « blunting ».79

• Comment améliorer la couverture vaccinale ?
La vaccination est l’un des plus grands succès dans la lutte infectieuse en protégeant la population à l’échelle individuelle et collective. Pourtant, la France reste le pays où la défiance vaccinale est la plus importante80. Il est donc important de promouvoir la vaccination et afin d’augmenter la couverture vaccinale, différentes actions à différents
niveaux sont possibles.
– Informations délivrées par les professionnels de santé
Les professionnels de santé doivent fournir à leur patiente une information claire, loyale et appropriée sur les bénéfices de la vaccination. Une étude évaluant les pratiques vaccinales anti-coqueluche chez la femme enceinte par les professionnels de santé évaluait à 92 % le taux de praticiens connaissant les recommandations en vigueur concernant la vaccination anti-coqueluche pendant la grossesse mais 80 % d’entre
eux la proposent à leur patiente et seulement 67 % vaccinent eux-mêmes leurs patientes81. Le manque de connaissance des praticiens concernant les recommandations vaccinales apparait comme l’un des principaux freins.
– Améliorer la confiance vaccinale
La défiance vaccinale, défi nie comme une réticence ou un refus d’être vacciné malgré la disponibilité des vaccins, est une des principales menaces sur la santé mondiale selon l’OMS82. La France reste le pays le plus vaccino-sceptique83. Dérivé du « modèle 3C » de l’OMS, le « modèle 5C » évalue 5 déterminants de l’hésitation vaccinale afin d’élaborer des stratégies pour améliorer la campagne vaccinale84,85 :
• Confidence : confiance de la population sur l’efficacité et sécurité du vaccin, système de santé et les professionnels impliqués dans la campagne vaccinale, les législateurs décidant de la politique vaccinale.
• Complecency (complaisance) : perception individuelle du risque lié à la maladie (comment la personne qui perçoit le risque d’infection comme peu sévère et qui estime donc que le vaccin n’est pas indispensable.
• Constraints (contrainte) : l’ensemble des contraintes exercées sur la campagne vaccinale : disponibilité et prix du vaccin, accessibilité à la vaccination, compréhension des enjeux…
• Calculation : l’implication de chaque individu à s’informer sur la maladie et le vaccin puis à établir de lui-même le rapport bénéfice / risque de la vaccination.
• Collective responsability (responsabilité collective) : Volonté à se faire vacciner pour protéger l’ensemble de la population via l’immunité collective. A partir de ce modèle, il est alors possible de proposer différentes stratégies d’amélioration :
• Campagnes d’informations compréhensibles par tous (schéma,
langage adapté…) et basées sur des preuves scientifi ques
• Formation des professionnels de santé • Lutter contre la désinformation
• Mesures coercitives afi n de rendre la vaccination obligatoire
mais au risque d’éroder la confiance et de stigmatiser les
patients refusant de se faire vacciner
• Favoriser l’accès aux vaccins (vaccins disponibles en offi cine
ou directement en maternité, vaccination possible par plusieurs
types de professionnel de santé…)
La volonté à se faire vacciner pendant la grossesse dépend
de la confiance vaccinale préexistante à la grossesse mais
prend également en compte des facteurs spécifiques
regroupés dans le modèle 5P (dérivé du modèle 5C)86 :
• « Perceived information sufficiency » limitée par le manque d’inclusion des femmes enceintes dans les essais thérapeutiques et donc le manque d’informations sur l’efficacité et sécurité du vaccin.
• « Pregnancy protection of the mother and Fetus » : l’objectif principal de la femme enceinte est de ne pas être délétère pour le fœtus (plus de 75% de femmes enceintes refusaient de se faire vacciner contre le COVID-19 par peur d’effets secondaires chez le fœtus87).
• « Provider – Patient relationship » : la relation patient – médecin et l’information délivrée par le professionnel sont décisives pour encourager la vaccination.
• « Perceived benefit » : protection assurée par le vaccin sur la mère et le fœtus / nouveau-né.
• « Perceived disease susceptibility and severity ».
– En pratique, que répondre à une patiente qui est inquiète d’une vaccination en cours de grossesse ?
Lorsqu’une patiente exprime des craintes ou des inquiétudes quant à la vaccination pendant la grossesse pour elle-même ou pour son enfant à naître, il est important d’adopter une approche empathique et informative. Voici quelques points que l’on peut considérer dans sa réponse :
1. Écoute active : commencer par écouter attentivement ses préoccupations. Cela montre que l’on prend ses inquiétudes au sérieux.
2. Informations claires : fournir des informations basées
sur des preuves scientifi ques sur la sécurité et l’efficacité de la vaccination pendant la grossesse. Expliquer que les vaccins recommandés pendant la grossesse ont fait l’objet d’études approfondies et ont contribué à établir leur sûreté. Expliquer comment la vaccination peut protéger la mère et son nouveau-né contre certaines maladies dangereuses.
3. Risques et avantages : discuter des potentiels risques liés à la maladie évitée par la vaccination par rapport aux risques associés au vaccin lui-même. Le plus souvent, les risques liés à la maladie peuvent être bien plus importants que ceux associés au vaccin. Mettre en évidence les avantages de la vaccination pour la mère et le bébé, en particulier en termes de protection contre des maladies potentiellement graves. Souligner les avantages de la vaccination pour la protection du bébé, en particulier pendant les premiers mois de vie, lorsque son système immunitaire est encore immature. Concernant la grippe, expliquer que le vaccin est conçu pour offrir une protection contre les souches virales spécifiques incluses dans le vaccin pour la saison en cours. Les experts en santé publique travaillent à prévoir les souches les plus susceptibles de circuler. Mentionner que même si une personne vaccinée contracte la grippe (puisque le vaccin ne garantit pas une protection à 100%), le vaccin va réduire la gravité des symptômes et le risque de complications graves, notamment chez les groupes à risque comme les femmes enceintes. Informer que les chercheurs ajustent régulièrement la composition du vaccin pour suivre l’évolution des souches virales, ce qui améliore son efficacité. Souligner les avantages du vaccin dans la prévention des hospitalisations liées à la grippe, en particulier chez les populations vulnérables. Expliquer que le vaccin contre la grippe peut jouer un rôle crucial dans la protection de sa santé et de celle de son bébé pendant la grossesse. Mettre en évidence le rôle du vaccin dans la protection de la communauté en réduisant la propagation de la grippe, ce qui est particulièrement important dans les environnements de soins de santé et les communautés où il y a des personnes vulnérables. Rassurer en expliquant que l’efficacité du vaccin est évaluée à travers des études continues et une surveillance épidémiologique, et que les autorités sanitaires ajustent les recommandations en conséquence.
Concernant la coqueluche, expliquer que le vaccin contre la coqueluche administré pendant la grossesse vise à protéger à la fois la mère et le nouveau-né. Les nourrissons sont particulièrement vulnérables à la coqueluche, et la vaccination pendant la grossesse peut aider à transmettre une protection temporaire au bébé. Mentionner que lorsque la mère reçoit le vaccin, elle développe des anticorps qui peuvent être transmis au fœtus, offrant une protection pendant les premiers mois de vie du bébé, avant qu’il ne puisse être vacciné lui-même. Souligner que la coqueluche peut être grave, voire mortelle, chez les nourrissons. La vaccination de la mère pendant la grossesse est une mesure préventive visant à réduire le risque de complications chez le nouveau-né. Informer que des études ont montré que la vaccination contre la coqueluche pendant la grossesse est efficace pour protéger les nourrissons. Cela inclut des données sur la réduction des cas de coqueluche sévère chez les nourrissons. Souligner que les vaccins recommandés pendant la grossesse, y compris celui contre la coqueluche, ont été étudiés pour leur sécurité chez les femmes enceintes et sont considérés comme sûrs. Rassurer en indiquant que la vaccination contre la coqueluche pendant la grossesse est recommandée par de nombreuses autorités sanitaires nationales et internationales en raison de ses avantages prouvés. Quant au COVID-19, il faut expliquer que l’objectif principal du vaccin est de prévenir des formes maternelles sévères en cas d’infection par le SARS-CoV2. Comme le vaccin antigrippal qui s’adapte chaque année aux souches saisonnières, le vaccin anti-COVID-19 est également « mis à jour » régulièrement en fonction des variants circulants et de leur potentiel infectieux. Il est également important de rappeler que le vaccin ne prévient pas la transmission virale entre individus mais prévient les symptômes et le risque d’évolution vers les formes sévères. La grossesse est un facteur de risque avéré de complications et il est nécessaire d’encourager également la vaccination de l’entourage proche. Il faut par ailleurs rassurer sur la sécurité du vaccin pour la mère et son fœtus car les études sont rassurantes quant à un éventuel effet tératogène.
Enfin la vaccination anti-COVID-19 est recommandée chez les femmes enceintes par les autorités de santé de très nombreux pays ».
Si une patiente exprime des craintes concernant les adjuvants des vaccins et s’inquiète de leur impact sur son bébé, on peut aborder ces préoccupations en fournissant des informations factuelles et rassurantes. Expliquer que les adjuvants sont des substances ajoutées aux vaccins pour renforcer la réponse immunitaire. Les adjuvants utilisés dans les vaccins sont soigneusement évalués pour leur sécurité. Souligner que les adjuvants utilisés dans les vaccins sont soumis à des tests rigoureux avant d’être approuvés pour une utilisation. Ils ont fait l’objet de nombreuses études de sécurité et sont considérés comme sûrs. Indiquer que de nombreux vaccins, y compris ceux administrés pendant la grossesse, contiennent des adjuvants. Des millions de femmes enceintes ont reçu
des vaccins contenant des adjuvants sans effets indésirables graves. Rappeler les avantages de la vaccination pendant la grossesse, notamment la protection de la mère et du bébé contre des maladies potentiellement graves. Les risques
associés à certaines maladies sont souvent beaucoup plus élevés que ceux associés aux vaccins. Informer que les vaccins recommandés pendant la grossesse sont conformes
aux lignes directrices émises par des autorités de santé nationales et internationales et que ces recommandations sont basées sur des preuves scientifiques solides.
4. Expérience et recherche : mentionner les études de recherche qui appuient l’utilisation sûre des vaccins pendant la grossesse et souligner que les vaccins recommandés pendant la grossesse ont contribué à prévenir des maladies chez de nombreuses femmes enceintes et leurs bébés.
5. Calendrier de vaccination : informer la patiente que le calendrier de vaccination pendant la grossesse est établi de manière à maximiser les bénéfices tout en minimisant les risques. Les vaccins sont souvent recommandés à des moments spécifiques pour optimiser la protection de la patiente et de l’enfant à naître.
6. Consultation médicale : encourager la patiente à discuter de ses préoccupations avec son obstétricien, sa sage-femme ou son médecin traitant. Les professionnels de la santé peuvent fournir des informations spécifiques à la situation individuelle de la patiente.
7. Prise de décision partagée : impliquer la patiente dans le processus de prise de décision. Expliquer que la vaccination est une mesure préventive et que la décision finale lui appartient, mais qu’elle peut bénéficier de conseils médicaux. Chaque patiente est unique, et la manière dont on a bordela question peut varier en fonction de ses préoccupations spécifiques. L’objectif est de fournir des informations précises pour l’aider à prendre une décision éclairée en collaboration avec son équipe médicale.

PERSPECTIVES VACCINALES CHEZ LA FEMME ENCEINTE
• Infection à Streptocoque B
Les infections néonatales restent rares mais sévères et sont essentiellement dues au Streptocoque B88. La prévention des infections néonatales au Streptocoque B repose sur le dépistage systématique, par prélèvement vaginal, entre 34 et 38 SA et par l’administration d’Amoxicilline pendant le travail en cas de portage. L’antibioprophylaxie permet de réduire de 80 % les infections néonatales précoces (survenant dans les 7 jours) mais reste peu efficace dans le cas des infections tardives89.
Un essai de phase II, randomisé en double aveugle, chez des patientes enceintes recevant un placebo ou une dose du vaccin GBS6 a montré des résultats favorables sur la prévention du risque d’infection néonatale à Streptocoque B : 57 à 97 % des
nouveaux nés de mères vaccinés présentaient un taux d’IgG supérieur au seuil pour réduire de 75 % le risque d’infection90. Si les essais de phase III sont concluants et la demande de mise sur le marché acceptée par les instances de santé, le vaccin
GBS6 pourrait changer la stratégie de prévention des infections néonatales à Streptocoque B. Dans une étude cherchant à évaluer les motivations et barrières des patientes à se faire vacciner contre le Streptocoque B, les résultats étaient positifs avec plus de 70 % de réponses favorables à se faire vacciner, principalement pour protéger le futur nouveau-né91.
• Infection à VRS
Le virus respiratoire syncytial (VRS) est un virus à ARN qui se transmet par voie aérienne ou par contact avec des objets souillés. Il est responsable d’épidémie saisonnière de bronchiolite en pédiatrie. L’hiver 2022 – 2023 a été marqué par plus de 73 000 passages aux urgences pédiatriques pour bronchiolite dont 26 000 hospitalisations92. Cette épidémie particulièrement intense fut responsable d’une saturation du système de santé avec mise en place du « plan blanc » dans certaines régions. En l’absence de traitement spécifique efficace, les mesures thérapeutiques sont surtout préventives d’ordre hygiéno-diététique (lavage des mains et des objets, éviter les collectivités avant 3 mois…)93 et médicamenteuses avec l’administration d’anticorps monoclonal, tel que Palivizumab, chez les plus enfants les plus vulnérables94 ou le Nirvésimab recommandé chez tous les enfants de moins d’un an nés après le 6 février 202395 et autorisé depuis 2023 en France. Des études ont montré qu’une vaccination maternelle anti VRS pendant la grossesse réduirait de 55 à 63 % le taux de mortalité liée au VRS chez les enfants de moins de 6 mois96. Depuis 2023, le vaccin RSVpreF® est autorisé aux États Unis par la FDA et dans certains pays européens par l’EMA mais les autorités françaises ne se sont pas encore exprimées sur la place de cette stratégie (sans doute pour l’hiver 2023-2024). Son administration repose sur une seule dose entre 24 et 36 SA97.
CONCLUSION
Utilisés depuis plusieurs siècles, les vaccins ont permis d’éradiquer certaines maladies infectieuses. La vaccination s’est alors imposée comme l’outil le plus efficace dans la lutte contre les maladies infectieuses pendant la grossesse. Ainsi, administrés lors d’une grossesse, ils protègent les femmes enceintes de formes sévères, diminuent le risque de morbidité obstétricale et confèrent aux nouveau-nés une protection antiinfectieuse pendant leurs premiers mois de vie. Malgré une accessibilité facile à la vaccination assurée par le système de santé français, les objectifs vaccinaux restent le plus souvent non atteints. Ceci s’explique en partie par une forte défiance vaccinale d’une partie de de la population. Les campagnes d’information, l’éducation de la population et l’action des professionnels de santé restent primordiales pour faciliter l’adhésion à la vaccination.
L’auteur ne déclare pas de liens d’intérêt avec le sujet traité
Stanley Soussan1,2, Vincent Portet-Sulla3,4,5, Charles Egloff1,2, Christelle Vauloup-Fellous3,4,5, Olivier Picone1,2,5,6,7
1.Service de Gynécologie-Obstétrique, Hôpital Louis-Mourier, AP-HP, Colombes, France
2.Universié Paris Cité, Paris, France
3.Division of Virology, WHO Rubella National Reference Laboratory, Dept of Biology Genetics, Hôpital Paul Brousse, Paris Saclay University Hospital, APHP, Villejuif, France
4. Paris Saclay University, INSERM U1184, CEA, Center for Immunology of Viral, Auto-immune, Hematological and Bacterial diseases (IMVA-HB/IDMIT), Fontenay-aux-Roses, France
5. Groupe de Recherche sur les Infections et la grossesse (GRIG)
6. IAME, INSERM, Paris, France
7. FHU PREMA, Paris, France
1. Vaccines and immunization [Internet]. [cité 12 oct 2023]. Disponible sur: https://www.who.int/health-topics/vaccines-and-immunization
2. Tlaxca JL, Ellis S, Remmele RL. Live attenuated and inactivated viral vaccine formulation and nasal delivery: potential and challenges. Adv Drug Deliv Rev. 1 oct 2015;93:56-78.
3. Recent Developments in Vaccine Design: From Live Vaccines to Recombinant Toxin Vaccines – PMC [Internet]. [cité 12 oct 2023]. Disponible sur: https:// www-ncbi-nlm-nih-gov.ezproxy.u-paris.fr/pmc/articles/PMC10536331/
4. Pollard AJ, Bijker EM. A guide to vaccinology: from basic principles to new developments. Nat Rev Immunol. 2021;21(2):83-100.
5. The innate and adaptive immune systems. In: InformedHealth.org [Internet] [Internet]. Institute for Quality and Efficiency in Health Care (IQWiG); 2020 [cité 29 nov 2023]. Disponible sur: https://www.ncbi.nlm.nih.gov/books/NBK279396/
6. Iwasaki A, Medzhitov R. Control of adaptive immunity by the innate immune system. Nat Immunol. avr 2015;16(4):343-53.
7. wasaki A, Omer SB. Why and How Vaccines Work. Cell. 15 oct 2020;183(2):290-5.
8. Tai Y, Wang Q, Korner H, Zhang L, Wei W. Molecular Mechanisms of T Cells Activation by Dendritic Cells in Autoimmune Diseases. Front Pharmacol. 26 juin 2018;9:642.
9. Clem AS. Fundamentals of Vaccine Immunology. J Glob Infect Dis. 2011;3(1):73-8.
10. ieson DJ, Theiler RN, Rasmussen SA. Emerging Infections and Pregnancy. Emerg Infect Dis. nov 2006;12(11):1638-43.
11. Butcher MJ, Zhu J. Recent advances in understanding the Th1/Th2 effector choice. Fac Rev. 15 mars 2021;10:30.
12. Moser M, Leo O. Key concepts in immunology. Vaccine. août 2010;28:C2-13.
13. Sallusto F, Lanzavecchia A, Araki K, Ahmed R. From Vaccines to Memory and Back. Immunity. 29 oct 2010;33(4):451-63.
14. Growth and function of the normal human placenta. Thromb Res. 1 janv 2004;114(5-6):397-407.
15. Atkinson DE, Boyd RDH, Sibley CP. CHAPTER 52 – Placental Transfer. In: Neill JD, éditeur. Knobil and Neill’s Physiology of Reproduction (Third Edition) [Internet]. St Louis: Academic Press; 2006 [cité 14 oct 2023]. p. 2787-846. Disponible sur: https://www.sciencedirect.com/science/article/pii/ B9780125154000500579
16. Brett KE, Ferraro ZM, Yockell-Lelievre J, Gruslin A, Adamo KB. Maternal–Fetal Nutrient Transport in Pregnancy Pathologies: The Role of the Placenta. Int J Mol Sci. sept 2014;15(9):16153-85.
17. Hamilton RG. Human IgG subclass measurements in the clinical laboratory. Clin Chem. oct 1987;33(10):1707-25.
18. Jauniaux E, Jurkovic D, Gulbis B, Liesnard C, Lees C, Campbell S. Materno-fetal immunoglobulin transfer and passive immunity during the first trimester of human pregnancy. Hum Reprod Oxf Engl. déc 1995;10(12):3297-300.
19. Malek A, Sager R, Kuhn P, Nicolaides KH, Schneider H. Evolution of Maternofetal Transport of Immunoglobulins During Human Pregnancy. Am J Reprod Immunol. 1996;36(5):248-55.
20. WATABE H, GITLIN JI, GITLIN D. Further Characterization of IgG Receptors from Human Placenta1. J Biochem (Tokyo). 1 févr 1980;87(2):393-7.
21. A major histocompatibility complex class I-like Fc receptor cloned from human placenta: possible role in transfer of immunoglobulin G from mother to fetus. J Exp Med. 1 déc 1994;180(6):2377-81.
22. Leach JL, Sedmak DD, Osborne JM, Rahill B, Lairmore MD, Anderson CL. Isolation from human placenta of the IgG transporter, FcRn, and localization to the syncytiotrophoblast: implications for maternal-fetal antibody transport. J Immunol. 15 oct 1996;157(8):3317-22.
23. Placental transport of immunoglobulin G. Vaccine. 28 juill 2003;21(24):3365-9.
24. Firan M, Bawdon R, Radu C, Ober RJ, Eaken D, Antohe F, et al. The MHC class I-related receptor, FcRn, plays an essential role in the maternofetal transfer of gamma-globulin in humans. Int Immunol. août 2001;13(8):993-1002.
25. Malek A, Sager R, Schneider H. Maternal-fetal transport of immunoglobulin G and its subclasses during the third trimester of human pregnancy. Am J Reprod Immunol N Y N 1989. août 1994;32(1):8-14.
26. Einarsdottir HK, Stapleton NM, Scherjon S, Andersen JT, Rispens T, van der Schoot CE, et al. On the Perplexingly Low Rate of Transport of IgG2 across the Human Placenta. PLoS ONE. 24 sept 2014;9(9):e108319.
27. Thomann M, Schlothauer T, Dashivets T, Malik S, Avenal C, Bulau P, et al. In Vitro Glycoengineering of IgG1 and Its Effect on Fc Receptor Binding and ADCC Activity. PLoS ONE. 12 août 2015;10(8):e0134949.
28. Wormald MR, Rudd PM, Harvey DJ, Chang SC, Scragg IG, Dwek RA. Variations in oligosaccharide-protein interactions in immunoglobulin G determine the site-specific glycosylation profiles and modulate the dynamic motion of the Fc oligosaccharides. Biochemistry. 11 févr 1997;36(6):1370-80.
29. Bondt A, Rombouts Y, Selman MHJ, Hensbergen PJ, Reiding KR, Hazes JMW, et al. Immunoglobulin G (IgG) Fab glycosylation analysis using a new mass spectrometric high-throughput profiling method reveals pregnancy-associated changes. Mol Cell Proteomics MCP. nov 2014;13(11):3029-39.
30. Huhn C, Selman MHJ, Ruhaak LR, Deelder AM, Wuhrer M. IgG glycosylation analysis. Proteomics. févr 2009;9(4):882-913.
31. Atwell JE, Thumar B, Robinson LJ, Tobby R, Yambo P, Ome-Kaius M, et al. Impact of Placental Malaria and Hypergammaglobulinemia on Transplacental Transfer of Respiratory Syncytial Virus Antibody in Papua New Guinea. J Infect Dis. 1 févr 2016;213(3):423-31.
32. Fu C, Lu L, Wu H, Shaman J, Cao Y, Fang F, et al. Placental antibody transfer efficiency and maternal levels: specific for measles, coxsackievirus A16, enterovirus 71, poliomyelitis I-III and HIV-1 antibodies. Sci Rep. 9 déc 2016;6:38874.
33. Brair ME, Brabin BJ, Milligan P, Maxwell S, Hart CA. Reduced transfer of tetanus antibodies with placental malaria. Lancet Lond Engl. 22 janv 1994;343(8891):208-9.
34. Scott S, Cumberland P, Shulman CE, Cousens S, Cohen BJ, Brown DWG, et al. Neonatal measles immunity in rural Kenya: the influence of HIV and placental
malaria infections on placental transfer of antibodies and levels of antibody in maternal and cord serum samples. J Infect Dis. 1 juin 2005;191(11):1854-60.
35. de Moraes-Pinto MI, Verhoeff F, Chimsuku L, Milligan PJ, Wesumperuma L, Broadhead RL, et al. Placental antibody transfer: influence of maternal HIV infection and placental malaria. Arch Dis Child Fetal Neonatal Ed. nov 1998;79(3):F202-205.
36. Abu-Raya B, Smolen KK, Willems F, Kollmann TR, Marchant A. Transfer of Maternal Antimicrobial Immunity to HIV-Exposed Uninfected Newborns. Front Immunol. 2016;7:338.
37. Moore JS, Wu X, Kulhavy R, Tomana M, Novak J, Moldoveanu Z, et al. Increased levels of galactose-deficient IgG in sera of HIV-1-infected individuals. AIDS Lond Engl. 4 mars 2005;19(4):381-9.
38. Palmer AC. Nutritionally mediated programming of the developing immune system. Adv Nutr Bethesda Md. sept 2011;2(5):377-95.
39. Cavalcante RS, Kopelman BI, Costa-Carvalho BT. Placental transfer of Haemophilus influenzae type b antibodies in malnourished pregnant women. Braz J Infect Dis Off Publ Braz Soc Infect Dis. févr 2008;12(1):47-51.
40. Fowden AL, Ward JW, Wooding FPB, Forhead AJ, Constancia M. Programming placental nutrient transport capacity. J Physiol. 1 avr 2006;572(Pt 1):5-15.
41. Reynolds LP, Borowicz PP, Caton JS, Vonnahme KA, Luther JS, Buchanan DS, et al. Uteroplacental vascular development and placental function: an update. Int J Dev Biol. 11 nov 2009;54(2-3):355-65.
42. Stach SCL, Brizot ML, Liao AW, Palmeira P, Francisco RPV, Carneiro-Sampaio MMS, et al. Placental transfer of IgG antibodies specific to Klebsiella and Pseudomonas LPS and to group B Streptococcus in twin pregnancies. Scand J Immunol. févr 2015;81(2):135-41.
43. Chen H, Xu J, Lu Q, Ma T. Immunohistochemical analysis of globulin and complements in blood vessels of placental villi during pregnancy induced hypertension. J Tongji Med Univ Tong Ji Yi Ke Xue Xue Bao. 1996;16(4):253-6.
44. Simister NE. Placental transport of immunoglobulin G. Vaccine. 28 juill 2003;21(24):3365-9.
45. Silveira Lessa AL, Krebs VLJ, Brasil TB, Pontes GN, Carneiro-Sampaio M, Palmeira P. Preterm and term neonates transplacentally acquire IgG antibodies specific to LPS from Klebsiella pneumoniae, Escherichia coli and Pseudomonas aeruginosa. FEMS Immunol Med Microbiol. juill 2011;62(2):236-43.
46. Kohler PF, Farr RS. Elevation of cord over maternal IgG immunoglobulin: evidence for an active placental IgG transport. Nature. 4 juin 1966;210(5040):1070-1.
47. Okoko BJ, Wesumperuma HL, Fern J, Yamuah LK, Hart CA. The transplacental transfer of IgG subclasses: influence of prematurity and low birthweight in the Gambian population. Ann Trop Paediatr. déc 2002;22(4):325-32.
48. Okoko JB, Wesumperuma HL, Hart CA. The influence of prematurity and low birthweight on transplacental antibody transfer in a rural West African population. Trop Med Int Health TM IH. juill 2001;6(7):529-34.
49. van den Berg JP, Westerbeek EAM, Berbers GAM, van Gageldonk PGM, van der Klis FRM, van Elburg RM. Transplacental transport of IgG antibodies specific for pertussis, diphtheria, tetanus, haemophilus influenzae type b, and Neisseria meningitidis serogroup C is lower in preterm compared with term infants. Pediatr Infect Dis J. sept 2010;29(9):801-5.
50. van den Berg JP, Westerbeek EAM, Smits GP, van der Klis FRM, Berbers GAM, van Elburg RM. Lower transplacental antibody transport for measles, mumps, rubella and varicella zoster in very preterm infants. PloS One. 2014;9(4):e94714.
51. Omer SB. Maternal Immunization. N Engl J Med. 30 mars 2017;376(13):1256-67.
52. Le Bouteiller P. HLA-G et immunité placentaire locale. Gynécologie Obstétrique Fertil. 1 sept 2003;31(9):782-5.
53. Kayem G, Batteux F. [Immunology of pregnancy]. Presse Medicale Paris Fr 1983. nov 2008;37(11):1612-9.
54. aham JJ, Longhi MS, Heneghan MA. T helper cell immunity in pregnancy and influence on autoimmune disease progression. J Autoimmun. 1 juill 2021;121:102651.
55. Nouveau-nés: réduire la mortalité [Internet]. [cité 15 oct 2023]. Disponible sur: https://www.who.int/fr/news-room/fact-sheets/detail/newbornsreducing-mortality
56. Recomma ANSM [Internet]. [cité 12 oct 2023]. Dossier thématique – Vaccination et grossesse. Disponible sur: https://ansm.sante.fr/dossiersthematiques/medicaments-et-grossesse/vaccination-et-grossesse
58. Kroger AT, Atkinson WL, Marcuse EK, Pickering LK, Advisory Committee on Immunization Practices (ACIP) Centers for Disease Control and Prevention (CDC). General recommendations on immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep Morb Mortal Wkly Rep Recomm Rep. 1 déc 2006;55(RR-15):1-48.
59. calendrier_vaccinal_maj-juin23.pdf [Internet]. [cité 19 oct 2023]. Disponible sur: https://sante.gouv.fr/IMG/pdf/calendrier_vaccinal_maj-juin23.pdf
60. Gaythorpe KA, Hamlet A, Jean K, Garkauskas Ramos D, Cibrelus L, Garske T, et al. The global burden of yellow fever. eLife. 16 mars 2021;10:e64670.
61. Loubet P, Guerrisi C, Turbelin C, Blondel B, Launay O, Bardou M, et al. Influenza during pregnancy: Incidence, vaccination coverage and attitudes toward vaccination in the French web-based cohort G-GrippeNet. Vaccine. 29 avr 2016;34(20):2390-6.
62. Wang R, Yan W, Du M, Tao L, Liu J. The effect of influenza virus infection on pregnancy outcomes: A systematic review and meta-analysis of cohort studies. Int J Infect Dis. 1 avr 2021;105:567-78.
63. Avis relatif à l’actualisation de la vaccination contre la grippe saisonnière dans certaines populations (femmes enceintes et personnes obèses) du 16 février 2012, HCSP.
64. Couverture vaccinale contre la grippe des femmes enceintes, proposition de vaccination et étude des déterminants, France métropolitaine 2019 – 2021. Santé Publique Fr [Internet]. 18 janv 2023 [cité 19 oct 2023]; Disponible sur: http://beh.santepubliquefrance.fr/beh/2023/17/2023_17_3.html
65. Mehrabadi A, Dodds L, MacDonald NE, Top KA, Benchimol EI, Kwong JC, et al. Association of Maternal Influenza Vaccination During Pregnancy With Early Childhood Health Outcomes. JAMA. 8 juin 2021;325(22):2285-93.
66. Herrera Gómez A. [SAFETY AND EFFICACY OF INFLUENZA VACCINE IN PREGNANCY]. Rev Enfermeria Barc Spain. févr 2015;38(2):38-41.
67. Swamy GK, Wheeler SM. Neonatal pertussis, cocooning and maternal immunization. Expert Rev Vaccines. 1 sept 2014;13(9):1107-14.
68. Dawood FS, Varner M, Tita A, Newes-Adeyi G, Gyamfi-Bannerman C, Battarbee A, et al. Incidence and Clinical Characteristics of and Risk Factors for Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection Among Pregnant Individuals in the United States. Clin Infect Dis. 6 juill 2022;74(12):2218-26.
69. Chinn J, Sedighim S, Kirby KA, Hohmann S, Hameed AB, Jolley J, et al. Characteristics and Outcomes of Women With COVID-19 Giving Birth at US Academic Centers During the COVID-19 Pandemic. JAMA Netw Open. 11 août 2021;4(8):e2120456.
70. Epelboin S, Labrosse J, Mouzon JD, Fauque P, Gervoise-Boyer MJ, Levy R, et al. Obstetrical outcomes and maternal morbidities associated with COVID19 in pregnant women in France: A national retrospective cohort study. PLOS Med. 30 nov 2021;18(11):e1003857.
71. i SQ, Bilodeau-Bertrand M, Liu S, Auger N. The impact of COVID-19 on pregnancy outcomes: a systematic review and meta-analysis. CMAJ. 19 avr 2021;193(16):E540-8.
72. 21-07-12 vaccination anti Covid-19 et femmes enceintes_rappel-2.pdf [Internet]. [cité 19 oct 2023]. Disponible sur: https://cngof.fr/app/pdf/Medias//
Communiqu%C3%A9s%20de%20Presse/21-07-12%20vaccination%20anti%20Covid-19%20et%20femmes%20enceintes_rappel-2.pdf?x53169
73. COVID-19 Vaccines and Pregnancy: Conversation Guide for Clinicians [Internet]. [cité 19 oct 2023]. Disponible sur: https://www.acog.org/covid-19/ covid-19-vaccines-and-pregnancy-conversation-guide-for-clinicians
74. COVID-19 Vaccination for Pregnant and Breastfeeding Women | Figo [Internet]. 2021 [cité 20 oct 2023]. Disponible sur: https://www.figo.org/ covid-19-vaccination-pregnant-and-breastfeeding-women
75. Shimabukuro TT, Kim SY, Myers TR, Moro PL, Oduyebo T, Panagiotakopoulos L, et al. Preliminary Findings of mRNA Covid-19 Vaccine Safety in Pregnant Persons. N Engl J Med. 21 avr 2021;NEJMoa2104983.
76. Jorgensen SCJ, Drover SSM, Fell DB, Austin PC, D’Souza R, Guttmann A, et al. Newborn and Early Infant Outcomes Following Maternal COVID-19 Vaccination During Pregnancy. JAMA Pediatr. 23 oct 2023;e234499.
77. Décret n° 2023-736 du 8 août 2023 relatif aux compétences vaccinales des infirmiers, des pharmaciens d’officine, des infirmiers et des pharmaciens exerçant au sein des pharmacies à usage intérieur, des professionnels de santé exerçant au sein des laboratoires de biologie médicale et des étudiants en troisième cycle des études pharmaceutiques – Légifrance [Internet]. [cité 17 oct 2023]. Disponible sur: https://www.legifrance.gouv.fr/jorf/id/ JORFTEXT000047948973
78. Décret n° 2023-737 du 8 août 2023 relatif aux compétences vaccinales des sages femmes. 2023-737 août 8, 2023.
79. Kandeil W, Savic M, Ceregido MA, Guignard A, Kuznetsova A, Mukherjee P. Immune interference (blunting) in the context of maternal immunization with Tdap-containing vaccines: is it a class effect? Expert Rev Vaccines. avr 2020;19(4):341-52.
80. Larson HJ, De Figueiredo A, Xiahong Z, Schulz WS, Verger P, Johnston IG, et al. The State of Vaccine Confidence 2016: Global Insights Through a 67-Country Survey. EBioMedicine. oct 2016;12:295-301.
81. Bonville CA, Cibula DA, Domachowske JB, Suryadevara M. Vaccine attitudes and practices among obstetric providers in New York State following the recommendation for pertussis vaccination during pregnancy. Hum Vaccines Immunother. 25 févr 2015;11(3):713-8.
82. Ten health issues WHO will tackle this year [Internet]. [cité 23 oct 2023]. Disponible sur: https://www.who.int/news-room/spotlight/ten-threatsto-global-health-in-2019
83. Ward JK, Peretti-Watel P, Bocquier A, Seror V, Verger P. Vaccine hesitancy and coercion: all eyes on France. Nat Immunol. oct 2019;20(10):1257-9.
84. MacDonald NE. Vaccine hesitancy: Definition, scope and determinants. Vaccine. 14 août 2015;33(34):4161-4.
85. Betsch C, Schmid P, Heinemeier D, Korn L, Holtmann C, Böhm R. Beyond confidence: Development of a measure assessing the 5C psychological antecedents of vaccination. PLoS ONE. 7 déc 2018;13(12):e0208601.
86. Cox E, Sanchez M, Taylor K, Baxter C, Crary I, Every E, et al. A Mother’s Dilemma: The 5-P Model for Vaccine Decision-Making in Pregnancy. Vaccines. juill 2023;11(7):1248.
87. Egloff C, Couffignal C, Cordier AG, Deruelle P, Sibiude J, Anselem O, et al. Pregnant women’s perceptions of the COVID-19 vaccine: A French survey. PloS One. 2022;17(2):e0263512.
88. Van Dyke MK, Phares CR, Lynfield R, Thomas AR, Arnold KE, Craig AS, et al. Evaluation of Universal Antenatal Screening for Group B Streptococcus. N Engl J Med. 18 juin 2009;360(25):2626-36.
89. Schrag SJ, Verani JR. Intrapartum antibiotic prophylaxis for the prevention of perinatal group B streptococcal disease: Experience in the United States and implications for a potential group B streptococcal vaccine. Vaccine. 28 août 2013;31:D20-6.
90. Madhi SA, Anderson AS, Absalon J, Radley D, Simon R, Jongihlati B, et al. Potential for Maternally Administered Vaccine for Infant Group B Streptococcus. N Engl J Med. 20 juill 2023;389(3):215-27.
91. Preparing for Group B Streptococcus vaccine. Attitudes of pregnant women in two countries [Internet]. [cité 23 oct 2023]. Disponible sur: https://
www-tandfonline-com.ezproxy.u-paris.fr/doi/epdf/10.1080/21645515.2023.2195331 needAccess=true
92. Bronchiolite : bilan de la surveillance hivernale 2022-2023 | Santé publique France [Internet]. [cité 23 oct 2023]. Disponible sur: https://www. santepubliquefrance.fr/les-actualites/2023/bronchiolite-bilan-de-la-surveillance-hivernale-2022-2023
93. Stratégie de prévention des bronchiolites à VRS des nourrissons : avis des Sociétés savantes françaises de pédiatrie. J Pédiatrie Puériculture. juin 2023;36(3):123-4.
94. Guillois B. Indications et modalités de prescription du Synagis®. Arch Pédiatrie. 1 janv 2007;14:S16-23.
95. Réponses Rapides : Nirsévimab (BEYFORTUS ®) dans la prévention des bronchiolites à virus respiratoire syncytial (VRS) chez les nouveau-nés et les nourrissons. 2023;
96. Maternal vaccination against RSV can substantially reduce childhood mortality in low-income and middle-income countries: A mathematical modeling study – ScienceDirect [Internet]. [cité 23 oct 2023]. Disponible sur: https://www-sciencedirect-com.ezproxy.u-paris.fr/science/article/pii/ S2590136223001201?via%3Dihub
97. Research C for BE and. ABRYSVO. FDA [Internet]. 14 sept 2023 [cité 23 oct 2023]; Disponible sur: https://www.fda.g