L’association d’un estrogène et d’un antiestrogène sélectif est efficace sur les symptômes de la ménopause ; elle prévient la perte osseuse et améliore la qualité de vie. Ces bénéfices sont obtenus sans les problèmes de sécurité et de tolérance associés aux progestatifs des THM.
Les traitements hormonaux de la ménopause apportent des bénéfices indiscutables sur le syndrome climatérique, le syndrome génito-urinaire et l’ostéoporose. Mais les effets négatifs de ce traitement sur les risques coronariens et vasculaires cérébraux, le risque de thromboembolies veineuses et le cancer du sein observés dans l’étude WHI ont donné un coup d’arrêt brutal à leur utilisation au niveau mondial. Les effets coronariens et mammaires ont été attribués à l’utilisation de progestatifs pourtant nécessaire à la protection endométriale chez les femmes non hystérectomisées.
Il a alors été imaginé d’associer à l’estrogène élément actif du THM, un anti-estrogène sélectif SERM protégeant l’endomètre sans obérer les effets positifs de l’estrogène sur les syndromes climatériques et génito-urinaires et la protection osseuse. Ainsi est né le concept de “Tissue-Selective Estrogen Complex (TSEC)”. Le premier représentant de cette nouvelle approche thérapeutique est l’association de 0,45 mg d’estrogènes conjugués équins et 20 mg de basedoxifène : Duavive®.
La baisse post-ménopausique des taux d’estrogènes peut entraîner un syndrome climatérique au premier rang duquel des bouffées de chaleur (BdC) gênantes chez 60 à 85 % des femmes en début de ménopause. Ces symptômes peuvent persister plus de 20 ans, en moyenne 5 ans. En post-ménopause, on constate également une perte osseuse qui augmente le risque d’ostéoporose.
De plus, 57 % des femmes en post-ménopause ont une atrophie vulvaire/vaginale. Les bouffées de chaleur détériorent la qualité de vie en provoquant des troubles du sommeil, des changements d’humeur, des déficits cognitifs en matière de concentration et de mémoire ainsi que des difficultés professionnelles.
Comme pour les bouffées de chaleur, les symptômes liés à l’atrophie vulvo-vaginale, telle que la sécheresse vaginale, impactent la qualité de vie de façon importante, avec des effets sur la sexualité, la fonction urinaire. Alors que jusqu’à 57 % des femmes en post-ménopause peuvent présenter des symptômes d’atrophie vulvovaginale, seules 20 à 25 % d’entre elles consultent un médecin, du fait d’une gêne, de tabous sociaux ou culturels, et/ou de l’idée que ces symptômes sont normaux car liés au vieillissement.
Il est établi que les traitements hormonaux de la ménopause (THM) par estrogènes et progestatifs traitent efficacement les symptômes de la ménopause et préviennent l’ostéoporose diminuant ainsi les risques fracturaires. Cependant, les résultats des études WHI posent question sur l’utilisation du THM. Les conclusions initiales de WHI montrent une augmentation du risque de maladie coronarienne, de cancer du sein (KS), d’accidents vasculaires cérébraux (AVC) et de maladie thromboembolique veineuse (TEV), qui l’emporteraient sur les bénéfices du THM. Ceci, ajouté aux inconvénients tels que saignements ou douleurs/sensibilité mammaires, ont conduit de nombreuses femmes à arrêter leur traitement, mais environ 25 % des femmes qui arrêtent le traitement constatent une réapparition des symptômes, et à terme expose 40 % d’entre elles à un risque fracturaire. Secondairement d’autres études ont pondéré les résultats de WHI.
L’inquiétude quant à un potentiel danger du THM chez les femmes récemment ménopausées est moins grande que ce que l’on pensait. Chez les femmes sans utérus, utilisant des estrogènes seuls, les résultats furent bien meilleurs puisque l’on n’observe plus d’augmentation du risque coronarien ni de cancers du sein. Par ailleurs, bien que le niveau de preuve soit plus faible, l’utilisation d’autres modes thérapeutiques (estradiol transcutané associé à la progestérone ou la rétroprogestérone) chez des femmes avec utérus ne montre pas d’augmentation du risque de TEV, AVC, ni de KS.
TESC, l’association d’un estrogène et d’un antiestrogène sélectif
Le “Tissue-Selective Estrogen Complex (TSEC)”, association d’un estrogène et d’un anti-estrogène sélectif, qui combine la bazedoxifène (BZA) et estrogènes conjugués équins ECE (BZA/ECE), pourrait représenter une solution sûre pour traiter les symptômes ménopausiques et prévenir l’ostéoporose post-ménopausique. Le but de cet article est de discuter de l’intérêt de l’association bazedoxifène/estrogènes conjugués dans la gestion de ces symptômes et des risques.
Le concept de cette association est de pouvoir se passer du progestatif chez les femmes avec utérus pour garder les avantages du traitement estrogénique seul sans en obérer les bénéfices par l’adjonction d’un progestatif responsable des risques coronariens de cancer du sein observé dans WHI. Pour cela, il fallait trouver un SERM antagoniste sur l’endomètre mais non antagoniste sur la gestion des bouffées de chaleur, de l’os et des symptômes génitaux et urinaires.
De plus, il est aujourd’hui prouvé que les traitements par ECE seuls comme les traitements par certains SERM (tamoxifène ou raloxifène) diminuent l’incidence des cancers du sein, la cerise sur le gâteau serait que les produits de cette association gardent cette potentialité et pourquoi pas de manière synergique. Enfin, reste le problème du risque thromboembolique veineux, en effet les ECE et certains SERM (tamoxifène, raloxifène) l’augmentent. Quid alors de leur association : risques maintenus, risques se potentialisant ou risques s’annihilant ?
TSEC et symptômes de la ménopause
Les modulateurs sélectifs des récepteurs des estrogènes (SERM) ont été développés pour se lier aux récepteurs des estrogènes avec une activité agoniste ou antagoniste variable selon le tissu cible (utérus, glande mammaire, squelette). Le BZA dans les essais précliniques et cliniques est apparu être le meilleur candidat, à la fois en utilisation seule et combinée avec l’ECE. BZA/ECE est le premier TSEC dont le développement clinique est achevé et qui est référencé dans les agences de santé américaine et européenne.
Données cliniques de l’association bazedoxifène et estrogène conjugué équin
L’efficacité et la sécurité des BZA/ECE ont été évaluées dans des études phase 3 SMART (Selective estrogens, Menopause And Response to Therapy) randomisées en double aveugle, contrôlés versus placebo, chez des femmes en post-ménopause ayant un utérus. L’étude SMART1 est une étude d’effet-dose sur le syndrome climatérique avec plusieurs bras BZD/ECE, avec des doses variables de BZD, et ECE un bras raloxifène. L’étude SMART 2 a évalué les effets de BZA/ECE chez des femmes présentant des BdC modérées à sévères, l’étude SMART 3 chez des femmes présentant des symptômes d’atrophie vulvo-vaginale et l’étude SMART 5 incluait des sous-études sur l’ostéoporose, sur la densité mammaire et sur le sommeil. L’étude SMART 4 (Figure 1) a évalué BZA 20 mg/ECE 0,45 et 0,625 mg comparé à ECE 0,45 mg/MPA 1,5 mg et placebo chez des femmes entre 40 et 65 ans.
BZA 20 mg/ECE 0,45 et 0,625 mg ont amélioré de façon significative la densité minérale osseuse tout en maintenant une sécurité endométriale, et ont montré une bonne tolérance sur un an, ces résultats étant similaires à ceux de SMART 1. L’association retenue a été 20 mg de BZD à 0,45 mg d’ECE.

Effets sur les bouffées de chaleur
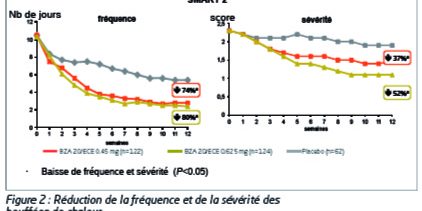
Dans l’étude SMART 1, l’efficacité de BZA/ECE sur les BdC a été évaluée sur un sous-groupe de femmes présentant un minimum de 7 BdC modérées à sévères par jour. Dans les deux analyses à semaine 4 et semaine 12, il a été montré que BZA 20 mg/ECE0,45 et 0,625 mg ont réduit de manière significative la moyenne quotidienne de BdC modérées à sévères (p<0,05) et la sévérité moyenne des BdC (p<0,001) par rapport au placebo. Ces effets perdurent pendantles deux années de traitement.
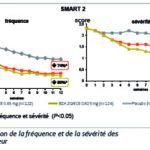
L’étude SMART 2 donne les mêmes résultats (Figure 2). A la semaine 4 et la semaine 12 de l’étude SMART 2 portant sur des femmes symptomatiques, BZA 20 mg/ ECE 0,45 et 0,625 mg ont réduit de façon significative le nombre et la sévérité des BdC comparé au placebo (P<0.001) : ces effets ont été observés dès la semaine 3. De plus, plus de femmes traitées par BZA 20 mg/ECE 0,45 ou 0,625 mg ont constaté une diminution d’au moins 75 % de la moyenne quotidienne de BdC comparées à celles traitées par placebo (P<0.001).
BZA 20 mg/ECE 0,45 ou 0,625 mg ont également augmenté de manière significative le nombre de jours sans BdC sur 12 semaines comparé au placebo.
Les femmes traitées par BZA 20 mg/ECE 0,45 ou 0,625 mg ont été plus satisfaites du contrôle des BdC pendant la journée et pendant la nuit (p<0.001) que les femmes traitées par placebo.
Les études SMART 1 et 2 ont démontré l’efficacité de BZA/ECE dans le soulagement des BdC chez les femmes symptomatiques en post-ménopause, indépendamment de l’origine ethnique et des années écoulées depuis la ménopause.
De plus, dans une méta-analyse, la réduction du nombre et de la sévérité des BdC sous BZA/ECE est comparable à celle observée sous THM.
Effets sur la qualité de vie liée à la santé, le sommeil et l’adhésion au traitement.
– Qualité de vie liée à la santé
Le questionnaire de la MENQOL (Menopause Specific Quality of Life) a été utilisé à 12 semaines dans l’étude SMART 1 pour mesurer la perception de la qualité de vie liée à la santé dans les domaines de la sexualité et des problèmes vasomoteurs. Les scores ont été améliorés de manière significative pour BZA 20 mg/ECE 0,45 et 0,625 comparé au placebo, à 12 semaines.
Dans les études SMART 1 et SMART 3, la perception de la qualité de vie liée à la santé a aussi été augmentée de manière significative sous BZA/ECE comparé au placebo à la semaine 12, comme l’ont montré les scores MENQOL en matière de fonction vasomotrice et totale. Les scores MENQOL en matière de fonction sexuelle ont été également améliorés par BZA 20 mg/ ECE 0,45 mg (P<0.001) ou BZA 20 mg/ECE 0.625 mg (p<0.01), comparé au placebo de l’étude SMART 3.
Dans l’étude SMART 5, les scores totaux et vasomoteurs MENQOL ont été augmentés de manière significative avec BZA/ECE comparé au placebo.
– Sommeil
Les paramètres du sommeil ont été évalués dans lesétudes SMART 1 et 2. A la semaine 13, BZA/ECE est associée à une amélioration significative de la qualité du sommeil, de la réduction de la durée moyenne de l’endormissement, et de l’augmentation de la moyenne des minutes de sommeil, de la satisfaction du sommeil
comparé au placebo.
– Atrophie vulvo-vaginale
Dans les études SMART 1 et 3, l’efficacité de BZA/ ECE sur les mesures de l’atrophie vulvo-vaginale a été évaluée sur un groupe de femmes qui n’avaient pas plus de 5 % de cellules vaginales superficielles au départ. A mois 24, le traitement BZA/ECE entraîne une maturation de l’épithélium vaginal, augmentant les pourcentages de cellules superficielles et diminuant le pourcentage de cellules parabasales comparé au placebo. Pendant les semaines 9 à 12, BZA/ECE était également associée avec un taux moindre de dyspareunie comparé au placebo.
Les deux doses de BZA/ECE 0,4 5 et 0,625 améliorent, comparé au placebo, de manière significative la plupart des symptômes d’atrophie vulvo-vaginale à la semaine 12 et réduit la sécheresse vaginale.
Comme l’a mesuré l’Arizona Sexual Experience Scale, on constate une amélioration de la fonction sexuelle et de la lubrification vaginale pour les deux doses de BZA/ ECE comparé au placebo.
Avantages comparés au THM classique
Les effets de BZA/ECE sur les saignements utérins, les douleurs mammaires, la densité mammaire ont été évalués dans les études cliniques de phase 3. Les associations BZA/ECE ont démontré des taux de saignements utérins et de douleurs mammaires similaires au placebo. De plus, les changements de densité mammaire sous BZA/ECE étaient similaires à ceux observés sous placebo. Sans compter, bien entendu, l’avantage lié à la non utilisation de progestatif sans effet endométrial délétère.
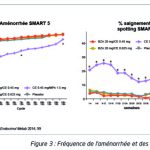
– Saignements et aménorrhée (Figure 3)
Les THM contenant des progestatifs peuvent entraîner des hémorragies de privations pour les traitementsséquentiels et des saignements utérins pour les traitements combinés continus. Ceci est source d’inquiétude pour les femmes et les médecins, nécessite des examens complémentaires, source d’angoisse, et augmente les coûts de santé.
Les taux d’aménorrhée cumulée (définie par l’absence de saignement ou de spotting) sont élevés avec BZA/ ECE dans les études SMART 1 et SMART 5 (respectivement supérieurs à 83 % et 85 %) sur deux ans, et similaires à ceux observés sous placebo. Dans l’essai SMART 5, les deux doses de BZA/ECE sont associées à des taux inférieurs de saignements et de spotting et à des taux plus élevés d’aménorrhée que ECE 0,45 mg/MPA 1,5 mg. L’incidence globale des arrêts de traitement liés aux saignements dans les études SMART 1 et 5 était la même pour BZA/ECE et le placebo, et inférieure à celle constatée sous ECE/MPA.
– Douleurs mammaires et sensibilité des seins
La sensibilité mammaire est un effet négatif commun dans le THM. L’incidence de la sensibilité des seins dans une étude en double aveugle randomisée va de 9 à 36 % après le début d’un ECE combiné au MPA.
Il n’existait pas de différence significative entre les groupes BZA/ECE et placebo dans le pourcentage des femmes qui se plaignent de douleurs mammaires (SMART 1 et 2) ou de sensibilité mammaire (SMART 5). Dans l’étude SMART 5, l’incidence de la sensibilité mammaire sous les deux doses BZA/ECE était inférieure comparé à ECE 0,45 mg/MPA 1.5.
– Densité mammaire
Le traitement par BZA/ECE n’a pas eu d’effet sur les changements liés à l’âge dans la densité mammaire mammographique (réduction naturelle de la densité mammaire tout au long de la ménopause). Les résultats des 2 études SMART 1 et 5 montrent que, contrairement au THM contenant des progestatifs, BZA/ECE a un effet neutre (similaire à celui du placebo et au raloxifène) sur la densité mammaire.
Sécurité
Sécurité endométriale
Dans les études SMART 1 et 5, l’incidence de l’hyperplasie de l’endomètre avec BZA/ECE était basse et similaire à celle du placebo. Aucun cas confirmé de cancer de l’endomètre n’a été observé avec BZA/ECE.
Sécurité mammaire
Dans l’étude SMART 1, l’incidence de mammographies anormales à 2 ans était similaire pour BZA 20 mg/ECE 0,45 mg (4,4 %) et le placebo (2,6 %), et dans SMART 1 l’incidence de mammographies anormales à un an était similaire entre BZA 20 mg/ECE 0,45 mg (0,9 %) et à BZA 20 mg/ECE 0,625 mg (0,4 %) et le placebo (0,2 %).
Sécurité générale
L’incidence globale d’effets secondaires au traitement était la même dans les groupes au sein des études SMART.
L’incidence des arrêts de traitement était basse et similaire entre BZA 20 mg/ECE 0,45 mg et le placebo dans une analyse poolée, ainsi que dans l’étude SMART 5.
Sécurité cardiovasculaire
L’incidence des TEV et des accidents cardiovasculaires n’est augmentée, avec BZA/ECE comparé au placebo, dans aucune des études SMART et dans leur analyse
poolée.
Conclusion
Il a été montré que BZA/ECE est à la fois efficace dans la réduction des symptômes ménopausiques (bouffées de chaleurs, symptômes génito-urinaires), qu’il prévient la perte osseuse post-ménopausique et qu’il augmente la qualité de vie. De multiples études, allant de 3 mois à 2 ans, chez des femmes en post-ménopause à l’utérus intact, ont montré que BZA/ECE donne les mêmes bénéfices que le THM dans le traitement des symptômes de la ménopause, sans les problèmes de sécurité et de tolérance associés aux progestatifs des THM.
Ceci confirme le concept de base visant à se passer de progestatifs avec ce THM, progestatifs responsables des effets coronarien et mammaire négatifs ayant amené de nombreuses femmes à se passer de THM. Cependant les données sur le risque de TEV bien que rassurantes restent à compléter. De même la sécurité mammaire qui théoriquement devrait être supérieure à celle du THM classique doit aussi continuer à faire l’objet d’un regard attentif. Enfin, si le bénéfice de cette association est sans doute net comparé au traitement de référence utilisé aux USA, ECE+MPA, une comparaison reste à faire avec le traitement de référence français estradiol transcutané associé à la progestérone naturelle. C’est bien la confirmation du risque veineux et l’effet mammaire qui seraient susceptibles d’emporter la décision. ■
Christian JAMIN, Paris
L’auteur déclare le lien d’intérêt suivant pour cet article : consultant pour MSD France.
RÉFÉRENCES
1. Pickar JH, MacNeil T, Ohleth K. SERMs: Progress and future perspectives. Maturitas 2010;67:129-38.
2.Pickar JH, Yeh IT, Bachmann G, Sperroff L. Endometrial effects of a Tissue-Selective estrogen complex containing basedoxifene/conjugated estrogens as a menopausal therapy. Fertil Steril 20089:92:1018-24.
3. Pinkerton JV, Utian WH, Constantine GD et al Relief of vasomotor symptoms with a tissue-selective estrogen complex containing bazedoxifene/conjugared estrogens: a randomized, controlled trial. Menopause 3009:16:1116-24.
4. Kagan R, Williams RS, Pan K et al A randomized, placebo-and active-controled trial of bazedoxyfene/conjugated estrogens for treatment of moderate to severe vulvar/vagina atrophy in post menopausal women. Menopause 2010;17:281-9.
5. Pinkerton JV, Harvey JA, Lindsay R et al Effedsts of bazedoxifene/conjugated estrogens on the endometrium and bone: a randomzed trial. J Clin Endocrinol Metab 2014;99:89-98.
6. Mirkin S, Komm BS et al Effects of bvazedoxufene/conjugated estrogens on endometrial safety and bone in postmenopausal women. Climateric 2013;16:338-46.
7. Palacios S, Currie H, Mikkola T, Dragon E. Perspectve on prescribing conjugated estrogens/basedoxifene for estrogen-deficiency symptoms of menopause : a pratical guide Maturitas 2015;80:425-40.
8. Pinkerton JV, HARVEY ja? Pan K. Breast effects of bazedoxifene/conjugated estrogens: a randomized controlled trial. Obstet Gynecol 2013;121:959-68.






25 commentaires