Cette spécialité à base de DHEA se transforme localement en quantités physiologiques d’estrogènes et d’androgènes. Elle a démontré son efficacité dans le traitement de l’atrophie vulvo-vaginale : restauration de la muqueuse vaginale et amélioration de la fonction sexuelle.
L’atrophie vulvo-vaginale (AVV) n’est plus ! Dites plutôt aujourd’hui : SGM ! En effet l’atrophie de la vulve et du vagin est l’une des composantes du Syndrome Génito-urinaire de la Ménopause (SGM) qui survient autour de la ménopause1.
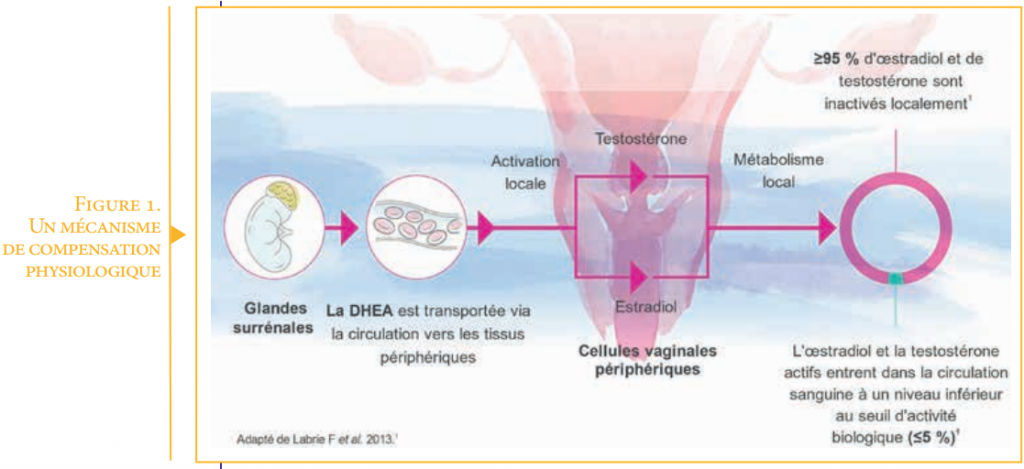
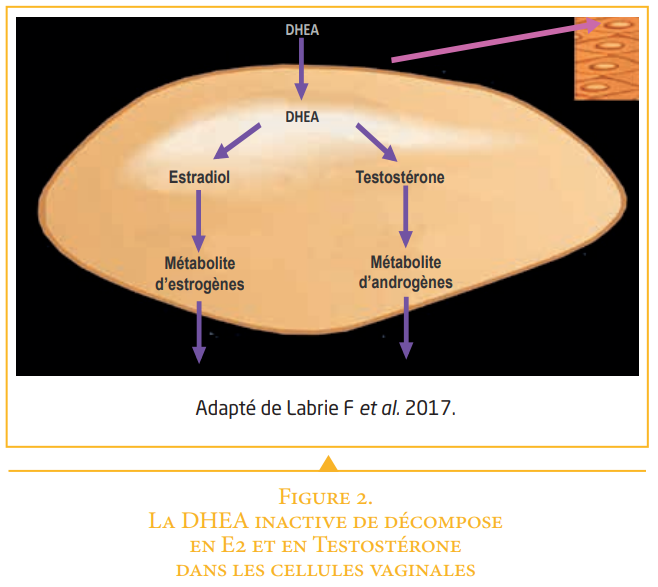
Dès l’arrêt de la fonction des ovaires, estrogènes, progestérone et testostérone ovariens ne sont plus secrétées. Un mécanisme de compensation physiologique est mis en place entre autres sources au travers de la DHEA (Figure 1). Cette DHEA est secrétée par les glandes surrénales et devient la source principale des stéroïdes sexuels. Au niveau du vagin elle est convertie localement en estrogènes et androgènes2,3. Cependant le taux de DHEA diminue avec l’âge4. Or, la DHEA ainsi que les hormones qu’elles libèrent localement (estrogènes et androgènes) sont indispensables à la bonne santé vaginale.
Leur diminution entraîne un amincissement des parois vaginales, une moindre élasticité des muqueuses et des niveaux de lubrification plus faibles.
Les modifications induites par le SGM se manifestent par 3 types de symptômes1 :
1. Les symptômes d’ordre génital : sécheresse, brûlure, irritation… Selon l’enquête européenne REVIVE5, 70 % des femmes concernées souffrent de sécheresse vaginale, 33 % d’irritations.
2. Les symptômes d’ordre sexuel : douleur ou inconfort pendant les rapports, altération de la fonction sexuelle. Elles sont 29 % à évoquer une dyspareunie5.
3. Les symptômes urinaires : incontinence d’effort, urgenturies, augmentation de l’incidence des infections vésicales.
Une symptomatologie mal prise en charge
Malgré la fréquence de ces symptômes moins d’une femme touchée sur deux bénéficie d’un traitement 6,7.
En cause, le manque d’éducation sur ce syndrome, et plus généralement sur les symptômes liés à la ménopause, qui amène 43 % des femmes à considérer qu’il fait partie du processus de vieillissement 5.
A cette méconnaissance s’ajoute la gêne d’aborder ce trouble jugé très intime 7.
Ce qui explique que 4 femmes sur 10 n’en parlent pas à leur gynécologue 6.
De leur côté, les professionnels de santé ne sont que 10 % à initier le sujet 5.
Il existe pourtant des recommandations officielles de l’International Menopause Society (IMS)8 sur l’importance de sensibiliser les femmes aux troubles de la santé sexuelle à la ménopause : celles-ci préconisent d’initier d’emblée la discussion sur la santé sexuelle en abordant les changements sexuels et les troubles susceptibles de survenir à la cinquantaine, d’identifier les signes cliniques et les symptômes, et enfin de déterminer la prise en charge la mieux adaptée.

Une nouvelle spécialité
La prasterone (Intrarosa®), identique à la DHEA humaine est une nouvelle spécialité disponible sous forme d’ovules disponible en France depuis mai 2019.
Mise en place dans le vagin, la prasterone est un précurseur inactif (Figure 2) qui pénètre dans les cellules vaginales et est converti de manière intracellulaire en petites quantités d’estrogènes et d’androgènes spécifiques aux cellules vaginales. Les effets bénéfiques sur les symptômes et les signes de l’atrophie vulvo-vaginale sont exercés à travers l’activation des récepteurs vaginaux estrogéniques et androgéniques.
C’est ce mécanisme qui explique le maintien lors du traitement de l’exposition systémique d’estradiol et de testostérone dans les valeurs normales observées chez la femme ménopausée non traitée9. La posologie est d’un ovule par jour au coucher. Chaque boîte contient 28 ovules et 6 applicateurs.
La spécialité est vendue en pharmacie au prix public conseillé de 29,90 €.
L’efficacité et la tolérance d’Intrarosa®
La spécialité a bénéficié de 2 principales études pivot pour son développement (Figure 3) :
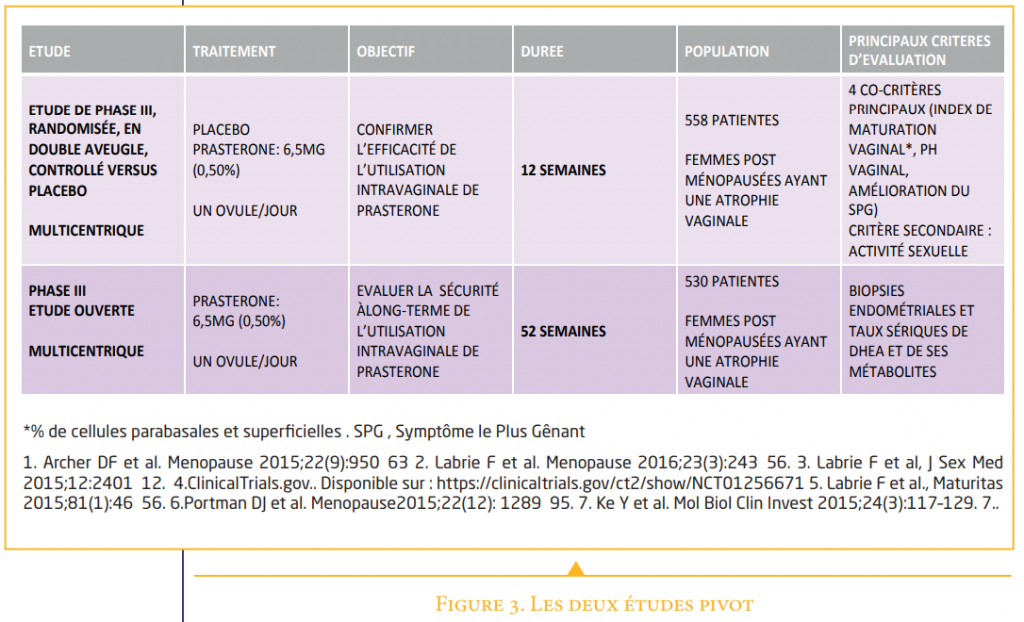
1/ La première étude clinique de Phase III a porté sur 12 semaines. Elle est de force 1 « Evidence Base Medicine ». En effet, elle est comme il se doit prospective randomisée, en double aveugle, contre placebo. N=180 placebo, n=374 6,5 mg prasterone(10). L’effet de la dose quotidienne de DHEA (6,5 mg) intravaginale (prasterone) a été étudié en évaluant 4 domaines :
1. Le pourcentage de cellules parabasales
2. Le pourcentage de cellules superficielles
3. Le pH vaginal
4. La dyspareunie modérée à sévère lors de l’activité sexuelle
Résultats : Après administration intravaginale quotidienne de 0,50% de DHEA pendant 12 semaines, par rapport au début du traitement, le pourcentage de cellules parabasales a diminué de 27,7% par rapport au placebo (p <0,0001), alors que le pourcentage de cellules superficielles a augmenté de 8,44% par rapport au placebo (p <0,0001), le pH vaginal a diminué de 0,66 unité de pH par rapport au placebo (p <0,0001) et la dyspareunie est diminuée de 1,42 unité par rapport au score de gravité de base ou 0,36 unité par rapport au placebo (P 0,0002). Par ailleurs, la sécheresse vaginale modérée à sévère, présente chez 84% des femmes, s’est améliorée à 12 semaines avec 1,44 unité de score de gravité par rapport au niveau initial, ou 0,27 unité par rapport au placebo (P 0,004). Lors de l’évaluation gynécologique, les sécrétions vaginales, l’intégrité épithéliale, l’épaisseur de la surface épithéliale et la couleur de la muqueuse s‘est améliorée de 86% à 121% par rapport au placebo (p <0,0001 pour toutes les comparaisons avec le placebo). Il n’y a pas eu de modifications des taux de stéroïdes sanguins circulants. Les seuls effets secondaires notés sont les pertes vaginales dues à la fonte de l’ovule chez environ 6% des femmes.
En conclusion, l’administration intravaginale quotidienne de Prasterone à 0,50% (6,5 mg) a montré cliniquement un rapport bénéfices/ risque élevé.
2/ La deuxième étude est une étude ouverte de 52 semaines et avait comme buts principaux d’évaluer :
1. Les modifications endométriales
2. Les taux sanguins de E2
3. Les taux sériques des autres stéroïdes sanguins
Résultats 11, 14 ,15 ,16
Biopsies endométriales
389 femmes ayant reçu 6, 5 mg de prasterone avaient suffisamment de tissu pour réaliser une évaluation histopathologique. – 385 (99%) avaient un endomètre atrophique
– 4 (1%) avaient un endomètre inactif
Epaisseur endométriale
– L’échographie endo-vaginale réalisée à la semaine 52 sur 43 participantes n’a montré aucun changement significatif de l’épaisseur endométriale.
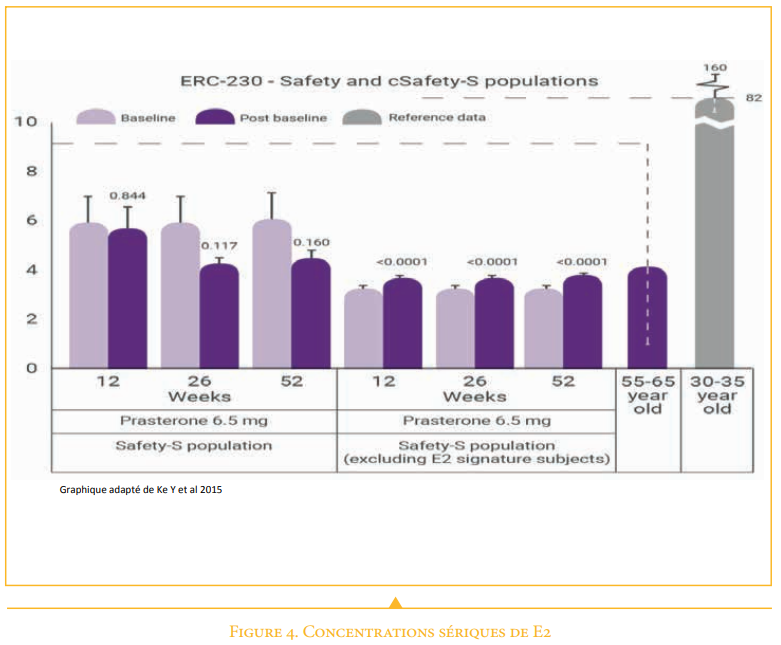
Taux d’E2 sérique
435 femmes ont reçu de la DHEA (prasterone) pendant 52 semaines.
– La valeur de E2 à la semaine 52 était comparable à la concentration moyenne d’E2 chez les femmes ménopausées non traitées. (Figure 4)
Les taux sériques des autres stéroïdes
Les taux sériques de DHEA, de testostérone et de l’ensemble des stéroïdes sexuels et leurs métabolites mesurés restent compris dans les limites des valeurs normales chez la femme ménopausée après 52 semaines de traitement.
L’impact positif de la prasterone sur la fonction sexuelle
Une étude13, randomisée de force 1 (vs placebo en double aveugle) a évalué les effets d’une dose quotidienne de 6,5 mg de prasterone à 6 et 12 semaines sur la dysfonction sexuelle de la femme en utilisant le questionnaire de qualité de vie sexuelle Female Sexual Function Index (FSFI). Le FSFI évalue 6 domaines clés sur 4 semaines : Désir, excitation, lubrification, orgasme, satisfaction et douleurs lors d’activité sexuelle. Le questionnaire FSFI a été complété à la visite d’inclusion jour 1, semaine 6 et 12 (ou à la visite de sortie si la patiente a été traitée au moins 6 semaines)
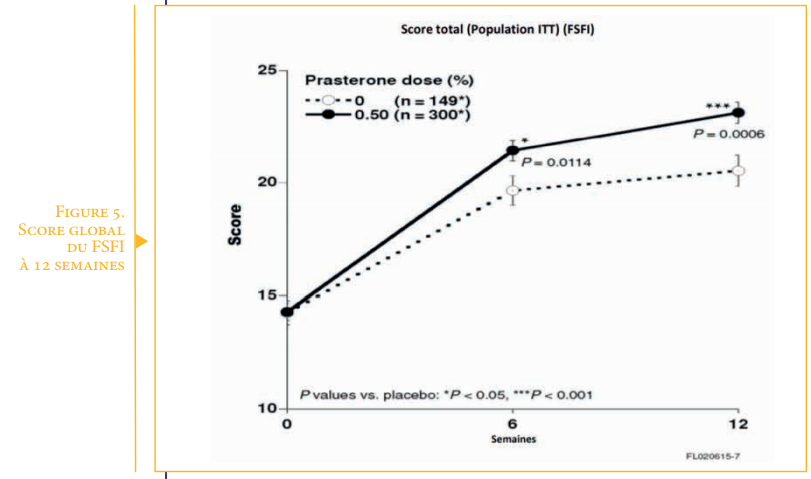
Résultats (Figure 5)
On note une amélioration de tous les items du FSFI. Le score global est amélioré de 41.3% avec la prasterone versus placebo (p = 0.0006 over placebo).
En conclusion,
l’Intrarosa® est la première spécialité à base de DHEA locale.
– Son efficacité et sa tolérance dans le traitement de l’atrophie vulvovaginale sont démontrées.
– La DHEA se transforme localement en quantités physiologiques d’estrogènes mais aussi d’androgènes.
– L’activité androgénique participe à la restauration de la muqueuse vaginale et améliore également la fonction sexuelle.
– Elle améliore le score du FSFI de 41,3 versus placébo.
– La valeur ajoutée du traitement par DHEA locale est l’apport combiné d’estrogènes mais aussi d’androgènes.
RÉFÉRENCES
1. Portman DJ et al. Vulvovaginal Atrophy Terminology Consensus Conference Panel. Maturitas 2014 ; 79(3):349�54 https://www. ncbi.nlm.nih.gov/pubmed/25179577
2. Simpson ER. J Steroid Biochem Mol Biol 2003; 86(3-5):225-30. https://www.sciencedirect.com/science/article/abs/pii/ S0960076003003601?via%3Dihub
3. Traish AM et al. Sex Med Rev 2018 Apr 6, 558-571 https://www.sciencedirect.com/science/article/pii/S2050052118300465
4. Labrie F et al. Menopause 2017 ; 24 :702-712
5. Enquête européenne REVIVE menée par Internet auprès de 3768 femmes ménopausées. Nappi Re Climateric 2016 vol 19, N2 188-197 disponible sur : https://www.tandfonline.com/doi/full/10.3109/13697137.2015.1107039
6. Enquête MIROIR Opinion Way 2016 menée auprès de 504 femmes âgées de 45 à 65 ans et de 100 gynécologues.
7. Enquête IFOP 2018 menée sur 1033 femmes de plus de 50 ans.
8. D. W. Sturdee and N. Panay, on behalf of the International Menopause Society Writing Group. Recommendations for the management of postmenopausal vaginal atrophy. CLIMACTERIC 2010; Early Online, 1–14 https://www.imsociety.org/manage/images/ pdf/135589732e80f53a3534c40c415867a7.pdf
9. RCP INTRAROSA.
10. Labrie and col.Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause, The Journal of The North American Menopause Society Vol. 23, No. 3, pp. 243-256
11. Portman DJ et al. Menopause 2015 ; 22(12): 1289�95. 1
2. Archer DF et al. Menopause 2015 ; 22(9):950�63
13. Labrie F et al, J Sex Med 2015;12:2401�12
14. ClinicalTrials.gov. Disponible sur : https://clinicaltrials.gov/ct2/show/NCT0125667
15. Labrie F et al., Maturitas 2015 ;81(1) :46�56.
16. KeY et al. Mol Biol Clin Invest 2015 ; 24(3) :117–129.







45 commentaires