Cancer du sein : dépistage des femmes à risque
QU’EST-CE QU’UNE FEMME À RISQUE ?
C’est une femme dont le risque de développer un cancer du sein est supérieur à la moyenne.
En France l’HAS distingue :
- Les femmes ayant un risque conforme à la moyenne et pour elles, elle recommande la participation au dépistage organisé entre 50 et 74 ans dont nous ne parlerons pas ici.
- Les femmes qui nécessitent un dépistage spécifique en raison de facteurs de risque particuliers :
– Antécédent personnel de cancer du sein (infiltrant ou canalaire in situ). Il est recommandé un examen clinique tous les six mois pendant deux ans puis annuellement associé à une mammographie annuelle +/- une échographie et ce sans limite de durée
– Antécédent d’irradiation thoracique à visée thérapeutique par exemple pour une maladie de Hodgkin ayant nécessité une irradiation en mantelet, la HAS recommande la réalisation d’un examen clinique annuel à partir de 8 ans après la fin de l’irradiation et au plus tôt à l’âge de 20 ans. Une IRM mammaire annuelle doit être effectuée à partir de 8 ans après la fin de l’irradiation et en complément de l’IRM une mammographie annuelle (une seule incidence oblique) en association avec une éventuelle échographie mammaire.
La aussi il n’y a pas de limite de durée.
– Antécédent personnel d’hyperplasie canalaire atypique, hyperplasie lobulaire atypique ou de carcinome lobulaire in situ : « La HAS recommande la réalisation d’une mammographie annuelle pendant 10 ans, en association éventuelle avec une échographie mammaire en fonction du résultat de la mammographie. Si, au terme de cette période de 10 ans, la femme a 50 ans ou plus, elle doit être incitée à participer au programme national de dépistage organisé. Si, au terme de cette période de 10 ans, la femme a moins de 50 ans, une mammographie en association éventuelle avec une échographie mammaire lui sera proposée tous les 2 ans jusqu’à l’âge de 50 ans.
La femme sera ensuite incitée à participer au programme national de dépistage organisé. »
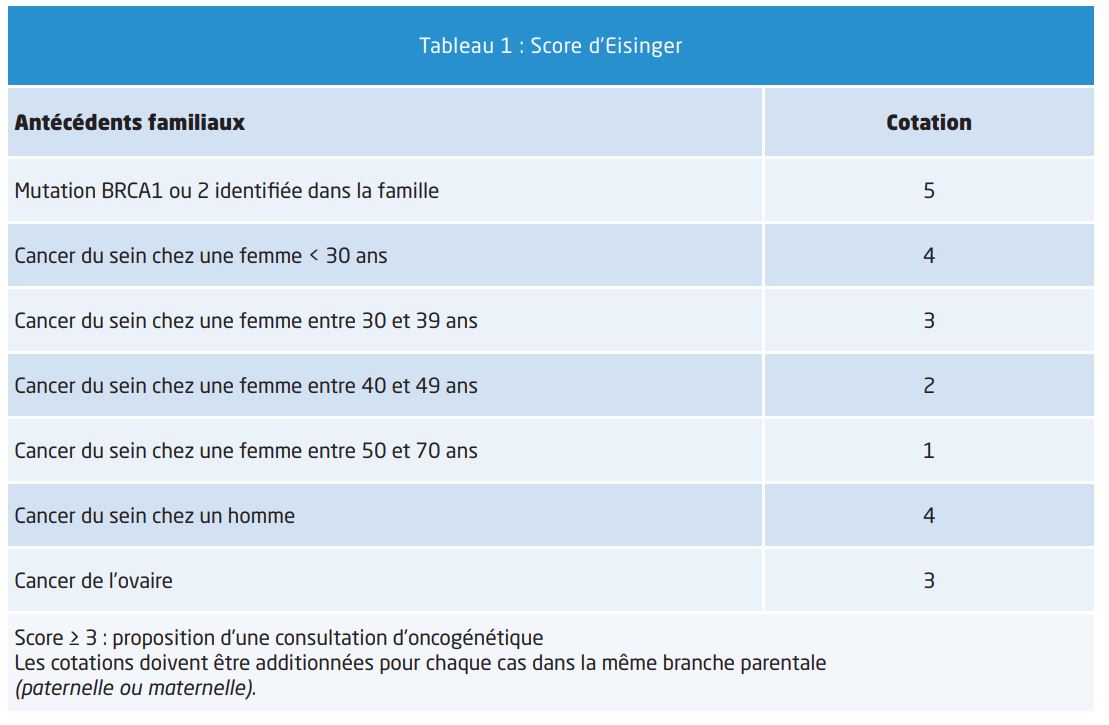
– En cas d’antécédent familial de cancer du sein il est recommandé de calculer le score d’Eisinger (Cf Tableau 1)
- En cas de score ≥ 3 il est proposé d’adresser la patiente en consultation d’oncogénétique. L’oncogénéticien établira alors si la patiente est à risque élevé ou à risque très élevé. Le risque très élevé correspond à un niveau de risque comparable à celui qui existe en cas de mutation BRCA. La surveillance proposée comporte un examen clinique tous les six mois, une IRM mammaire annuelle de première intention associée à une mammographie avec une seule incidence oblique externe par sein par technique numérique +/- une échographie en fonction de l’analyse du radiologue. L’imagerie est débutée à 30 ans ou 5 ans avant l’âge de survenue du plus jeune cancer du sein dans la famille et dans ce cas uniquement par IRM jusqu’à 30 ans. Ce bilan d’imagerie est poursuivi jusqu’à 65 ans ensuite il est recommandé de n’effectuer qu’une mammographie (2 incidences par sein) et d’arrêter l‘IRM. Cela dépendra bien sûr de la densité mammaire et de la facilité de lecture de la mammographie. Pour les femmes gardant des seins denses il semble logique de poursuivre l’IRM. En l’absence de mutation génétique mise en évidence mais avec un arbre généalogique évocateur du très haut risque héréditaire on effectuera la même surveillance
- Pour le risque élevé déterminé par l’oncogénéticien en fonction de l’arbre généalogique, il est proposé en règle de commencer le dépistage 5 ans avant l’âge de survenue du premier cancer dans la famille et au plus tôt à partir de 40 ans avec une mammographie annuelle (en association éventuelle avec une échographie mammaire) les cas justifiant d’un suivi radiologique plus précoce (avec IRM mammaire éventuelle) sont discutés au cas par cas. A partir de 50 ans il est proposé de repasser à une mammographie +/- échographie mammaire tous les deux ans.
Ces recommandations amènent à quelques remarques. Tout d’abord elles reposent essentiellement sur l’oncogénétique et ne tiennent pas compte ou très peu des autres facteurs de risque. Or en fait seuls 10% à 15% des cancers du sein sont liés à une mutation génétique. Il est curieux par ailleurs pour les hyperplasies atypiques et les CLIS de limiter le suivi annuel à 10 ans alors que les études montrent que le risque de développer un cancer infiltrant est grosso modo de 1% par an avec un risque qui persiste pendant 25 ans1. Enfin, pour faire le diagnostic d’hyperplasie atypique encore faut-il avoir fait une mammographie puisque c’est essentiellement la macrobiopsie d’un foyer de microcalcifications qui en permet le diagnostic. Cela pose donc le problème de l’âge de début du dépistage du cancer du sein. Les chiffres montrent qu’il y a autant de cancer du sein entre 45-50 ans et 50-55 ans. D’ailleurs la Société Américaine de Cancérologie recommande de débuter le dépistage à 45 ans avec une mammographie annuelle jusqu’à 55 ans puis tous les deux ans. D’autres sociétés toujours aux USA, proposent de débuter dès 40 ans (gynécologues, radiologues, National Comprehensive Cancer Network…) alors que d’autres (internistes, épidémiologistes) conseillent comme en France de ne débuter qu’à 50 ans. Ces divergences reposent bien sûr sur le rapport bénéfice/risque de la mammographie. Des méta-analyses et l’essai anglais AGE ont démontré un bénéfice du dépistage par mammographie dès 40 ans mais moindre qu’après 50 ans avec davantage de faux positifs et de faux négatifs. Un dépistage organisé par mammographie dès 40 ans n’est donc pas à l’ordre du jour mais il ne me semble pas illogique de proposer une mammographie de référence à 40 ans et d’adapter le dépistage (sur prescription individuelle) entre 40 et 50 ans en fonction des facteurs de risque significatifs (Risque Relatif > 2) : antécédent familial, pathologie bénigne à risque, densité mammaire… La densité n’est pas prise en compte en France alors qu’elle l’est dans le reste du monde, elle semble même le facteur de risque prépondérant avant la ménopause.2 De nombreuses études et réflexions sont en cours sur l’utilisation d’autres outils de dépistage que la mammographie numérique tous les deux ans. Certains proposent la tomosynthèse avec plusieurs obstacles : la dose d’irradiation pour le moment encore supérieure à celle de la mammographie numérique et l’absence de contrôle de qualité organisé. En revanche la tomosynthèse permet une meilleure détection des cancers infiltrants, une réduction des taux de faux positifs de l’ordre de 15% et une réduction du taux de rappel3. Des équipes et notamment celle de C. Kuhl en Allemagne, proposent pour le dépistage des cancers du sein chez les femmes jeunes avec des seins denses d’utiliser l’IRM avec un protocole abrégé sans injection (durée de l’examen 2 minutes, lecture de l’IRM 3 secondes) Elle décrit une plus grande efficacité qu’avec la tomosynthèse4.
De plus en plus d’équipes plaident pour passer d’un dépistage organisé identique pour tout le monde à un dépistage adapté en fonction de facteurs de risque. C’est notamment le cas du protocole européo-israélien My PEBS qu’impulse en France Suzette Delaloge. Ce protocole prend en compte les facteurs de risque classiques : antécédents familiaux de cancer du sein, antécédents de biopsies / lésion des seins, densité mammaire, IMC, âge de début du cycle, grossesses, traitements substitutifs de la ménopause et un score de risque polygénique (single nucleotide polymorphisms SNP) Il est mené chez des femmes volontaires de 40 à 74 ans et compare le dépistage standard actuel du cancer du sein à une stratégie personnalisée, qui propose des mammographies plus fréquentes aux femmes à risque élevé de cancer du sein, et moins fréquentes aux femmes à bas risque. Le groupe à bas risque effectue une mammographie tous les 4 ans, le groupe à risque modéré une mammographie tous les deux ans, le groupe à risque élevé une mammographie annuelle et le groupe à très haut risque une mammographie annuelle associée à une IRM annuelle jusqu’à 60 ans. Parallèlement des données biologiques seront étudiées. On étudiera le niveau d’anxiété des femmes, la qualité de vie, le rapport coût efficace…) On peut cependant s’interroger sur le critère de jugement qui est le taux de dépistage de cancers de stade ≥ 2 (cancer < 2 cm avec envahissement ganglionnaire, ou cancer mesurant entre 2 et 5 cm avec et sans envahissement ganglionnaire ou tumeur mesurant plus de 5 cm) ce qui correspond à bon nombre de cancers palpables ! Le but du dépistage me semblait de trouver des cancers infracliniques et par là en améliorer le pronostic. Par ailleurs l’appréciation de l’efficacité est fixée dans un premier temps à 4 ans, les études antérieures ont montré que pour apprécier l’efficacité d’un dépistage en termes de réduction de la mortalité il fallait 10 ans et plus de suivi.
Le dépistage des femmes à risque est donc de plus en plus codifié et clairement établi pour les femmes ayant un risque génétique. La difficulté pour les autres résidents dans le peu de facteurs de risque connus et dans le peu de « puissance » de ceux que nous connaissons les risques relatifs étant très majoritairement inférieurs à 2. Les polymorphismes génétiques et les scores de risque ainsi définis représentent très probablement une piste très intéressante, il faut cependant attendre le résultat des essais randomisés en cours pour avoir des certitudes5.
L’auteur de cet article n’a pas de liens d’intérêts envers cet article.
Marc Espié, Sénopôle Hôpital Saint Louis APHP, Paris
RÉFÉRENCES
- Hartmann LC, Sellers TA, Frost MH, Lingle WL, Degnim AC, Ghosh K, et al. Benign breast disease and the risk of breast cancer. N Engl J Med. 21 juill 2005;353(3):229-37.
- Engmann NJ, Golmakani MK, Miglioretti DL, Sprague BL, Kerlikowske K, Breast Cancer Surveillance Consortium. Population-Attributable Risk Proportion of Clinical Risk Factors for Breast Cancer. JAMA Oncol. 1 sept 2017;3(9):1228-36.
- Conant EF, Barlow WE, Herschorn SD, Weaver DL, Beaber EF, Tosteson ANA, et al. Association of Digital Breast Tomosynthesis vs Digital Mammography With Cancer Detection and Recall Rates by Age and Breast Density. JAMA Oncol. 1 mai 2019;5(5):635-42.
- Comstock CE, Gatsonis C, Newstead GM, Snyder BS, Gareen IF, Bergin JT, et al. Comparison of Abbreviated Breast MRI vs Digital Breast Tomosynthesis for Breast Cancer Detection Among Women With Dense Breasts Undergoing Screening. JAMA. 25 févr 2020;323(8):746-56.
- van den Broek JJ, Schechter CB, van Ravesteyn NT, Janssens ACJW, Wolfson MC, Trentham-Dietz A, et al. Personalizing Breast Cancer Screening Based on Polygenic Risk and Family History. J Natl Cancer Inst. 6 avr 2021;113(4):434-42








25 commentaires