LES GÈNES BRCA1 ET BRCA2 ONT ÉTÉ MIS EN ÉVIDENCE DANS LES ANNÉES 1990 ET LEURS MUTATIONS AUTHENTIFIÉES COMME ÉTANT RESPONSABLES, DE LA FORTE AUGMENTATION DU RISQUE DE SURVENUE D’UN CANCER DU SEIN OU DES OVAIRES OBSERVÉE AU SEIN DE CERTAINES FAMILLES (1), (2).
Ces cancers, notamment ceux associés à BRCA1, surviennent à un âge jeune avec plus fréquemment un phénotype agressif de type « triple négatif ». Ceci a justifié la mise en place de la recherche de ces mutations dans les familles à risque et chez les femmes atteintes à un âge jeune d’un cancer du sein ou des ovaires. Cette recherche a été étendue à un panel de gènes (en sus de BRCA1/2) potentiellement impliqués dans ces formes familiales (3). Parallèlement il a été proposé à ces femmes soit des chirurgies de réduction du risque, soit un dépistage précoce strictement codifié (4). Conjointement les inhibiteurs de PARP (polyadénosine diphosphate ribose polymérase) ont été développés pour traiter spécifiquement ces patientes en empêchant les mécanismes de réparation cellulaires liés aux PARP. En effet, l’autre voie majeure de réparation des cellules via BRCA ne peut pas agir en raison de la mutation, les anomalies au niveau de l’ADN vont s’accumuler et ceci entrainera la mort des cellules cancéreuses. L’efficacité de ces traitements a été mis en évidence chez des patientes avec des cancers des ovaires ou du sein (5), (6) mais également en cas de cancer du pancréas ou de la prostate (7), (8). En effet d‘autres localisations cancéreuses ont été associées aux variants pathogènes de BRCA sans que l’on ait de certitude absolue (petits échantillons, lien statistique faible, biais au niveau méthodologique…). Quoi qu’il en soit la participation de BRCA1 a été évoquée pour les cancers du sein chez l’homme, le cancer colo-rectal, le cancer de la vésicule et des canaux biliaires, le cancer du pancréas et le cancer de l’estomac et de BRCA2 pour le cancer du sein chez l’homme, certains cancers ophtalmologiques (mélanome choroïdien), le cancer du pancréas, le cancer de la prostate, le cancer de l’estomac (9) ainsi que les mélanomes (10).
L’étude de l’arbre généalogique est donc fondamentale pour analyser et interpréter ces résultats et adapter la surveillance et la prise en charge.
CHEZ QUI FAUT-IL EFFECTUER CETTE RECHERCHE ?
Les recommandations actuelles en France proposent d’adresser les patientes en consultation d’oncogénétique en fonction des antécédents familiaux et des antécédents personnels. Nous avons la chance d’avoir un réseau national impulsé par le groupe oncogénétique et cancer permettant la couverture de l’ensemble du territoire et de proposer d’effectuer des tests avec un contrôle de qualité et pris en charge intégralement.
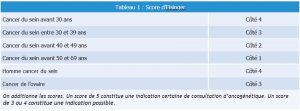
Cependant les délais d’accès aux consultations d’oncogénétique restent longs et encore plus le rendu des résultats. Jusqu’à présent c’est le score d’Eisinger qui permet de faire « le tri » dans cette proposition, avec des critères familiaux d’indication au test :
- ≥ 3 cas de cancers du sein diagnostiqués chez les apparentés au premier ou au second degré, appartenant à la même branche parentale (quels que soient les âges au diagnostic),
- 2 cas de cancers du sein diagnostiqués chez les apparentés au premier degré ou au second degré passant par un homme, dont : 1 cas avant 40 ans, ou 1 cas masculin ;
- 1 cas de cancer de l’ovaire et 1 cas de cancer du sein diagnostiqués chez des apparentés au premier degré ou au second degré passant par un homme (quels que soient les âges au diagnostic) (11) (Cf tableau 1).
Ces critères d’Eisinger ont été élargi en 2011 au niveau familial :
– Au moins 2 cas de cancer du sein ou de l’ovaire, quel que soit l’âge et au moins un cas de cancer du pancréas chez un apparenté du 1er ou du 2ème degré et au niveau individuel :
– Cancer de l’ovaire avant 61 ans, – cancer du sein isolé avant 36 ans, – cancer du sein triple négatif (RE-, RP-, Her2-) avant 51 ans, – cancer du sein chez l’homme quel que soit l’âge (13). La consultation d’oncogénétique aura donc pour but d’évaluer la probabilité de prédisposition héréditaire, d’identifier les sujets à risque, de préciser les probabilités de prédisposition par des données moléculaires, de proposer des modalités de prise en charge médicale des sujets à risque et de discuter des mesures de prévention. Pour le NCCN (14) aux Etats Unis d’Amérique les critères en 2021 ont été élargis et un test génétique doit être proposé :
1. En cas de parent porteur d’un gène muté,
2. En cas d’antécédent personnel de cancer du sein si le diagnostic a été fait à 45 ans ou avant, entre 46 et 50 ans si on ne connait pas l’histoire familiale, ou si un deuxième cancer du sein a été diagnostiqué ou s’il y a au moins un antécédent familial de cancer du sein, de l’ovaire, du pancréas ou de la prostate quel que soit l’âge ; en cas de diagnostic de cancer du sein triple négatif ≤ 60 ans ; si on a eu un cancer du sein à n’importe quel âge et si on est d’origine juive Ashkénaze ou avoir un antécédent proche avec un cancer du sein ≤ 50 ans ou un cancer de l’ovaire, du pancréas ou un cancer de la prostate à haut risque ou métastasé, ou avoir ≥ 3 diagnostic de cancer du sein chez le patient ou chez un parent proche. Avoir pour un homme, quel qu’en soit l’âge, un diagnostic de cancer du sein. Avoir un antécédent personnel de cancer des ovaires ou des trompes à n’importe quel âge, avoir un cancer du pancréas exocrine à n’importe quel âge, avoir un cancer de la prostate à n’importe quel âge en cas de métastases, d’histologie intra canalaire ou cribriforme, ou de très haut risque ou avoir un cancer de la prostate quel qu’en soit le risque ET une origine juive Ashkénaze ou ≥ un parent proche avec un cancer du sein ≤ 50 ans ou de l’ovaire ou du pancréas ou de la prostate métastasé ou intra canalaire ou cribriforme ou ≥ 2 parents proches avec soit un cancer du sein soit de la prostate à n’importe quel âge…
3. En cas d’antécédents familiaux de cancer du sein : chez un individu affecté ou non avec un antécédent au premier ou au deuxième degré ayant un des critères sus mentionnés, ou chez un individu affecté ou non qui n’a pas les critères susmentionnés mais qui a une probabilité > 5% d’avoir un variant pathogène de BRCA selon les modèles prédictifs (Tyrer Cuzick, BRCAPro, CanRisk). Un test peut également être envisagé en cas de multiples primitifs mammaires le premier ayant été diagnostiqué entre 50 et 65 ans ou chez un juif Ashkénaze, ou chez un individu affecté ou non qui ne remplit pas les critères précités mais qui a une probabilité de mutation BRCA entre 2,5 et 5% selon les modèles habituels. Il y a une faible probabilité qu’un test soit cliniquement utile chez les femmes qui ont eu un cancer du sein après 65 ans sans antécédent familial proche de cancer du sein, des ovaires, du pancréas ou de la prostate ainsi que chez les hommes avec un cancer de la prostate localisé avec un sore de Gleason < 7 et sans antécédent familial proche de cancer du sein, des ovaires, du pancréas ou de la prostate.
Cette liste est indigeste mais montre bien, l’extension des indications de recherche d’une mutation génétique qui s’est opérée ces dernières années aux USA.
En 2014, Mary-Claire King a même proposé d’effectuer un test BRCA pour toutes les femmes atteintes d’un cancer du sein et même pour toutes les femmes à l’âge de 30 ans. Cette proposition vise à éviter les échecs des politiques actuelles ou en fait la majorité des diagnostics de mutations se font chez des femmes qui ont déjà développé un cancer. Le but est donc de permettre un diagnostic le plus précoce possible chez les porteuses de mutation et de leur proposer des mesures de prévention efficaces, voire même dans le futur des thérapies ciblées adaptées (CF inhibiteurs de PARP). Cela permettrait également de faire des recherches familiales plus précoces, là encore en vue de mesures de prévention. En dehors des coûts un des problèmes de cette approche est : qui délivre l’information et les messages (mesures) qui y sont associés ? Pour des problèmes de nombre, ce ne sera bien sûr pas l’onco-généticien.
Des études ont été menées en Israël parmi la population juive Ashkénaze et il a été mis en évidence que 51% des femmes porteuses d’un variant pathogène avaient peu ou pas d’histoire familiale de cancer du sein, ce qui justifie ce dépistage systématique au sein de cette population.(15) Actuellement nous effectuons de plus en plus souvent des analyses de mutations de gènes au niveau tumoral chez des patientes qui sont opérées pour un cancer du sein en raison des répercussions thérapeutiques potentielles que cela peut entrainer notamment chez les femmes jeunes, en cas de cancer triple négatif(16) et si une mutation BRCA est mise en évidence au niveau de la tumeur une recherche de mutation constitutionnelle est proposée en urgence avec une consultation en oncogénétique pour modifier par exemple les indications chirurgicales (mastectomie plutôt que traitement conservateur). Pourrait-on déjà étendre ces recherches, avec leur consentement, à toutes les patientes opérées ? Ce n’est pas inenvisageable mais cela nécessite une charge de travail pour les anatomopathologistes très importante et également pour les onco-généticiens. Il convient également de bien prendre en compte les conséquences psychologiques importantes de ces diagnostics et des répercussions que cela entraine au niveau des familles concernées. Il faut bien se souvenir également que BRCA1 et BRCA2 ne sont pas les seuls gènes concernés et que des gènes mis en évidence par les recherches en NGS (analyse en séquençage à haut débit) peuvent être des gènes avec un très haut risque (RR > 4) et une forte pénétrance ou des gènes à risques modérés RR aux alentours de 2 où l’histoire familiale va être fondamentale et des gènes de risque faible (RR < 2) ce qui ne va pas sans poser des problèmes de prise en charge.
Dans l’idée de Mary Claire King (17) la recherche génétique devait concerner des gènes avec un très haut risque, bien évalué, de type BRCA1 ou BRCA2 en ne prenant en compte que les variants pathogènes et en « oubliant » les variants de signification inconnue. Elle envisageait d’y associer PALB2 le niveau de risque lui étant associé étant proche de celui de BRCA2. Cela impliquait d’accepter un certain taux de faux négatifs.
En 2015, Metcalfe et al (18) proposaient de dépister systématiquement tous les juifs Ashkénazes partant du principe que 2 mutations de BRCA1 et une mutation de BRCA2 étaient présentes chez 2,5% d’entre eux et étaient donc « faciles » à mettre en évidence. La fréquence de ces mutations étant d’environ 1/100 alors qu’elles sont de 1/500 en population générale. Ils proposaient d’effectuer le test à partir de 25 ans.
Une étude a été initiée en 2017 au Canada : « The Screen Project » Tous les Canadiens de plus de 18 ans et qui souhaitaient connaitre leur statut BRCA1 ou BRCA2 pouvaient y participer. Ils s’inscrivaient en ligne et on leur envoyait un kit pour recueillir un échantillon de leur salive. 1 269 personnes ont été testés (1 157 femmes et 87 hommes) entre mars 2017 et janvier 2019 (165 dollars US par test payé par les participants). Il leur était proposé de regarder une vidéo explicative. Il faut noter que le profil de ceux qui ont décidé de participer à ce projet n’est pas celui de la population générale : 66% d’entre eux avaient un antécédent familial de cancer du sein ou des ovaires au premier degré, 15,4% avaient un antécédent personnel de cancer du sein, 0,5% de cancer des ovaires, 0,8% de cancers de la prostate et 5% d’autres cancers. 78,3% n’avaient pas eu de cancer. 72% étaient de l’Ontario et la majorité avaient fait des études supérieures et avaient donc probablement des revenus élevés. Parmi les 1 269 individus testés, 30 (2,4%) avaient une mutation BRCA 1 ou 2 (20 femmes et 10 hommes) 75% des femmes ont effectué une mastectomie bilatérale de réduction du risque et/ou une annexectomie dans l’année qui a suivi le résultat. Il s’agit d’une démarche de type « consommateurs ». Un conseil génétique était possible sans frais mais n’a été demandé que par 5% des non porteurs de mutation. Les participants ont été majoritairement très satisfaits de la procédure (19). L’idée des auteurs était d’offrir « à un prix abordable » à tous les Canadiens en fonction de leur volonté un test génétique pour BRCA1 ou 2 en augmentant l’accès à ces tests, en réduisant les obstacles systémiques tels que l’accès obligatoire à un médecin référent, les longs délais et les critères restrictifs de sélection. Ils pensent que le conseil génétique n’est pas indispensable même s’il doit être possible. Les auteurs poursuivent leur projet et se proposent d’inclure d’autres gènes de prédisposition en cas de l’absence de variant pathogène de BRCA1 ou 2.
Au total il est clair que nous allons vers une extension des indications de recherche des variants pathogènes des gènes impliqués. Mais le problème reste compliqué tant pour des problèmes de structure que pour des problèmes de coûts et de qualité des rendus d’examens et de prise en charge des femmes concernées.
L’auteur de cet article n’a pas de liens d’intérêts avec cet article.
RÉFÉRENCES
1. Hall JM, Lee MK, Newman B, Morrow JE, Anderson LA, Huey B, et al. Linkage of early-onset familial breast cancer to chromosome 17q21. Science. 21 déc 1990;250(4988):1684-9.
2. Wooster R, Neuhausen SL, Mangion J, Quirk Y, Ford D, Collins N, et al. Localization of a breast cancer susceptibility gene, BRCA2, to chromosome 13q12-13. Science. 30 sept 1994;265(5181):2088-90.
3. Moretta J, Berthet P, Bonadona V, Caron O, Cohen-Haguenauer O, Colas C, et al. [The French Genetic and Cancer Consortium guidelines for multigene panel analysis in hereditary breast and ovarian cancer predisposition]. Bull Cancer. oct 2018;105(10):907-17.
4. Synthèse – Femmes porteuses d’une mutation de BRCA1 ou BRCA2 /Détection précoce du cancer du sein et des annexes et stratégies de réduction du risque, Collection recommandations et référentiels, INCa, avril 2017.
5. Tutt ANJ, Garber JE, Kaufman B, Viale G, Fumagalli D, Rastogi P, et al. Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer. N Engl J Med. 24 juin 2021;384(25):2394-405.
6. Moore K, Colombo N, Scambia G, Kim BG, Oaknin A, Friedlander M, et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 27 déc 2018;379(26):2495-505.
7. de Bono J, Mateo J, Fizazi K, Saad F, Shore N, Sandhu S, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 28 mai 2020;382(22):2091-102.
8. Golan T, Hammel P, Reni M, Van Cutsem E, Macarulla T, Hall MJ, et al. Maintenance Olaparib for Germline BRCA-Mutated Metastatic Pancreatic Cancer. N Engl J Med. 25 juill 2019;381(4):317-27.
9. Li S, Silvestri V, Leslie G, Rebbeck TR, Neuhausen SL, Hopper JL, et al. Cancer Risks Associated With BRCA1 and BRCA2 Pathogenic Variants. J Clin Oncol. 25 janv 2022;JCO2102112.
10. Breast Cancer Linkage Consortium. Cancer risks in BRCA2 mutation carriers. J Natl Cancer Inst. 4 août 1999;91(15):1310-6.
11. Risques héréditaires de cancers du sein et de l’ovaire : Quelle prise en charge? Rapport. Paris : Les éditions Inserm, 1998, XXVII- 635 p. – (Expertise collective). – http://hdl.handle.net/10608/201.
12. Inserm-FNCLCC. Risques héréditaires de cancer du sein et de l’ovaire : quelle prise en charge ? Paris: Editions Inserm 1998.
13. Bonaïti B, Alarcon F, Bonadona V, Pennec S, Andrieu N, Stoppa-Lyonnet D, et al. [A new scoring system for the diagnosis of BRCA1/2 associated breast-ovarian cancer predisposition]. Bull Cancer. juill 2011;98(7):779-95.
14. Daly MB, Pal T, Berry MP, Buys SS, Dickson P, Domchek SM, et al. Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 6 janv 2021;19(1):77-102.
15. Gabai-Kapara E, Lahad A, Kaufman B, Friedman E, Segev S, Renbaum P, et al. Population-based screening for breast and ovarian cancer risk due to BRCA1 and BRCA2. Proc Natl Acad Sci U S A. 30 sept 2014;111(39):14205-10.
16. Fostira F, Tsitlaidou M, Papadimitriou C, Pertesi M, Timotheadou E, Stavropoulou AV, et al. Prevalence of BRCA1 mutations among 403 women with triple-negative breast cancer: implications for genetic screening selection criteria: a Hellenic Cooperative Oncology Group Study. Breast Cancer Res Treat. juill 2012;134(1):353-62.
17. King MC, Levy-Lahad E, Lahad A. Population-based screening for BRCA1 and BRCA2: 2014 Lasker Award. JAMA. 17 sept 2014;312(11):1091-2.
18. Metcalfe KA, Eisen A, Lerner-Ellis J, Narod SA. Is it time to offer BRCA1 and BRCA2 testing to all Jewish women? Curr Oncol. août 2015;22(4):e233-236.
19. Narod SA, Gojska N, Sun P, Tryon A, Kotsopoulos J, Metcalfe K, et al. The Screen Project: Guided Direct-To-Consumer Genetic Testing for Breast Cancer Susceptibility in Canada. Cancers (Basel). 15 avr 2021;13(8):1894.
Marc Espié,
Sénopôle Hôpital Saint Louis APHP, Paris







37 commentaires