Échographie fœtale à 12 semaines d’aménorrhée
Il y a 20 ans, un Comité National Technique de l’Échographie de Dépistage Prénatal (CNTE) avait été créé à la demande du Ministère de la Santé pour répondre aux préoccupations des professionnels face aux décisions judiciaires de l’époque (affaire Perruche relative à l’indemnisation du préjudice d’être né).
Les deux objectifs de ce Comité étaient, d’une part, de promouvoir une politique d’assurance qualité de l’échographie de dépistage et, d’autre part, de développer une stratégie d’information du public quant à l’intérêt mais aussi aux limites de cet examen.
Et c’est en 2005 que le rapport de ce Comité avait été publié1.
Il contenait des recommandations de bonne pratique échographique pour chacun des trimestres de la grossesse. Il précisait l’ensemble des critères à respecter qui devenaient donc opposables aux praticiens : mesures biométriques, éléments de bien-être fœtal, descriptions anatomiques, imagerie.
Il faisait ensuite le point à la fois sur la nécessité d’une formation initiale mais aussi sur celle d’une formation continue. Il insistait également sur la qualité du matériel d’échographie nécessaire à la pratique du dépistage en instaurant une limite de durée de vie de l’appareillage à 7 ans.
En 2010, arrivé au terme de son mandat, ce Comité avait été dissous. Conscients de l’attente des professionnels et de nombreuses sociétés savantes, lui avait alors succédé, en dehors de toute tutelle ministérielle, la Conférence Nationale de l’Échographie Obstétricale et Fœtale (CNEOF). En 2016 la Conférence publiait une mise à jour2 en tenant compte de l’évolution des connaissances depuis ces dernières années. Elle confirmait en particulier les référentiels de bonnes pratiques concernant l’échographie obstétricale et fœtale déjà présents dans le rapport du CNTE.
De telles recommandations étaient également présentes au plan international. L’ISUOG (International Society of Ultrasound in Obstetrics and Gynecology) avait publié3 en 2013 un guide de bonnes pratiques de l’échographie fœtale.
En 2009 fut mise en place en France une nouvelle stratégie de dépistage des anomalies chromosomiques.
Au premier trimestre, cette stratégie était fondée sur le calcul d’un risque établi par combinaison de 3 éléments : âge maternel, mesure de la clarté nucale (CN) et dosage de marqueurs sériques maternels (hCG, PAPP-A).
Une telle stratégie imposait aux praticiens volontaires, en préalable à sa mise en œuvre, de participer à l’évaluation de leurs pratiques professionnelles (EPP) avant de pouvoir intégrer ce programme de dépistage organisé. Il s’agissait de développer un programme national d’assurance qualité.
Après participation et validation à ces EPP, ceux-ci furent accrédités et reçurent un agrément les autorisant à intégrer les Réseaux de Santé Périnatale.
LES OBJECTIFS DE L’ÉCHOGRAPHIE DU PREMIER TRIMESTRE
L’objectif de toute échographie de grossesse est de fournir des informations précises pour optimiser la prise en charge de la grossesse et assurer le bien-être de la mère et du fœtus. Elle s’intègre dans un vaste ensemble de mesures de surveillance mises en place pour réduire la mortalité et la morbidité périnatales d’une part et les risques de handicap d’autre part.
En début de grossesse, le but essentiel est de confirmer la viabilité, d’établir avec précision l’âge gestationnel avec une estimation éventuelle de la date de début de grossesse et, en présence d’une grossesse multiple, d’en préciser la chorionicité et l’amnionicité.
À la fin du premier trimestre, l’échographie permet de débuter l’étude de l’anatomie fœtale, de détecter certaines anomalies macroscopiques et de proposer un dépistage du risque d’aneuploïdie.
Il est en outre légitime d’informer clairement les femmes des limites de l’échographie de dépistage : des anomalies morphologiques peuvent soit se développer plus tardivement au cours de la grossesse soit ne pas pouvoir être détectées même avec un équipement approprié et entre les mains les plus expérimentées.
LES OBJECTIFS DE L’ÉCHOGRAPHIE À 12 SEMAINES D’AMÉNORRHÉE
Cet examen se réalise le plus souvent par voie abdominale (EA), superficielle. Il n’est cependant pas toujours possible d’obtenir l’ensemble des informations pertinentes dans ces conditions, le plus souvent en raison d’un IMC élevé. Il est alors légitime d’y associer la voie endovaginale (EV).
Les mêmes courbes de biométrie peuvent être utilisées pour les fœtus uniques et les grossesses multiples.
L’échographie qui nous intéresse ici est celle dite de 12 semaines d’aménorrhée. Elle se pratique entre 11 et 13, 6 jours semaines d’aménorrhée (SA). Il est généralement admis d’employer le terme d’embryon jusqu’à 10 SA puis de fœtus au-delà.
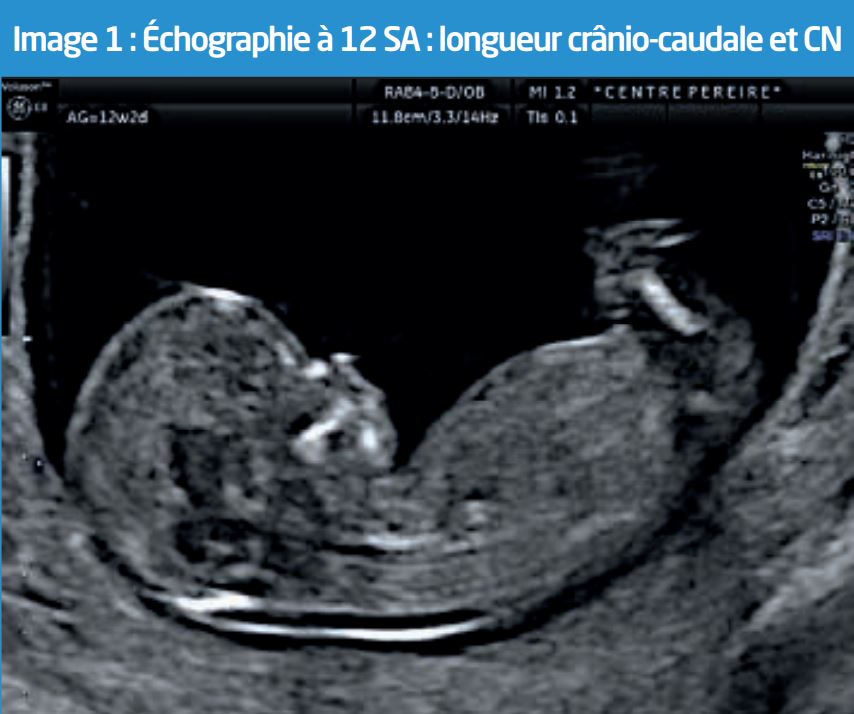
Sur le plan biométrique, la mesure de la longueur crânio-caudale (LCC) du fœtus doit donc impérativement être comprise entre 45 et 84 millimètres4 pour pouvoir valider une mesure de la CN prise en compte dans l’évaluation du risque combiné d’aneuploïdie. L’image obtenue doit par ailleurs répondre à un nombre précis de critères de qualité, représentés par le score de Herman5, pour être pertinente. En dehors de cette fourchette de LCC, aucune mesure de CN ne peut être retenue. (Image 1)
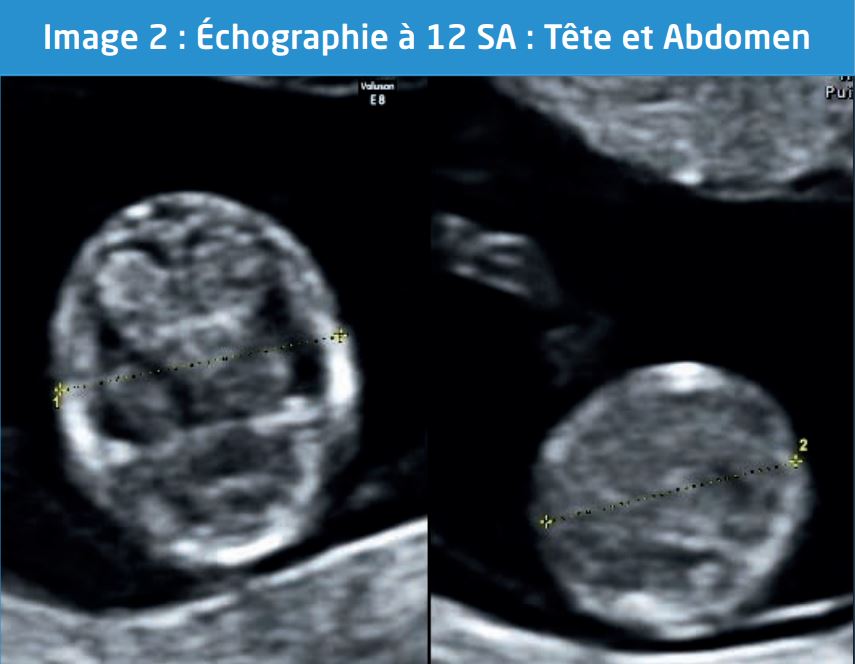
En plus de la LCC et la CN, la mesure du diamètre bipariétal est impérative. D’autres en revanche, comme celles du périmètre céphalique, du périmètre abdominal, de la longueur du fémur ou d’autres organes, si elles peuvent apparaître souhaitables, ne figurent explicitement ni dans les recommandations de la CNEOF ni dans celles de l’ISUOG. Des tables de croissance existent pour de nombreux organes dès 12 SA.
Sur le plan anatomique, il est indispensable de préciser l’aspect de certains organes. La CNEOF impose l’étude d’un nombre limité d’organes. Ils doivent alors être décrits comme étant « d’aspect habituel » après avoir été visualisés et considérés comme tels.
Il en est ainsi des contours osseux du pôle céphalique et de la faux du cerveau, de la paroi antérieure de l’abdomen (la hernie ombilicale physiologique disparaît à 11 SA), des 4 membres avec leurs 3 segments. (Image 2)
Les mouvements actifs, la fréquence cardiaque, le volume subjectif du liquide amniotique et l’aspect placentaire doivent être précisés.
Il faut cependant reconnaître qu’à ce protocole anatomique minimum, la plupart des praticiens du dépistage ajoutent des éléments et étoffent davantage ce premier bilan morphologique.
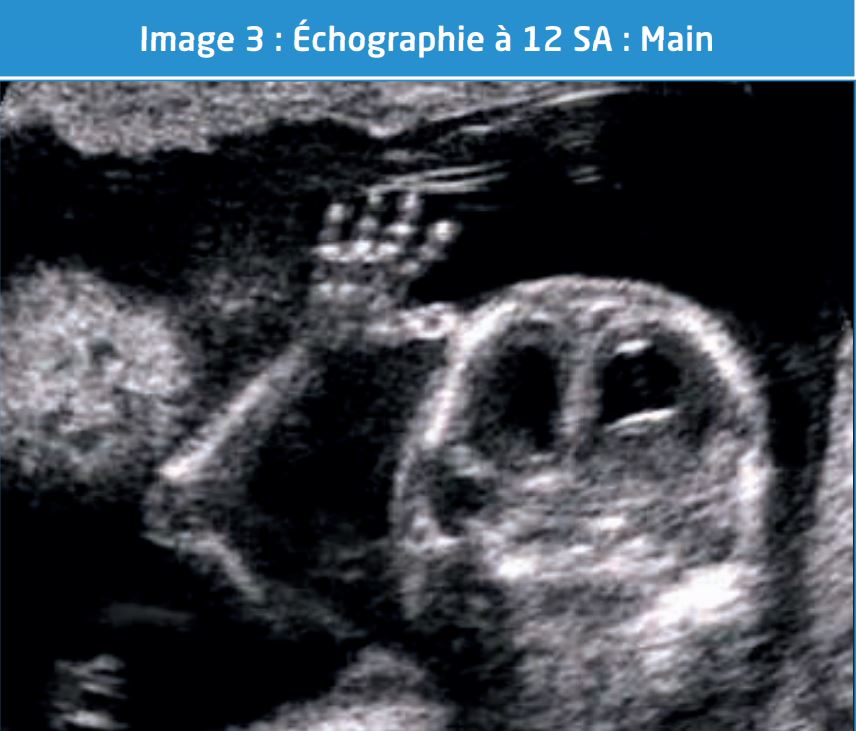
L’ISUOG suggère d’analyser par ailleurs, dans la mesure du possible, les plexus choroïdes, les orbites, l’os propre du nez, le rachis avec son revêtement cutané, les aires pulmonaires, la position du cœur (lévocardie) et les 4 cavités cardiaques, la présence et la localisation de l’estomac, la vessie, l’insertion cordonale, l’absence d’épanchement thoracique et abdominal.
Le taux de visualisation de ces structures entre 12 et 13 SA évolue entre 95 et 100% en associant EA et EV si nécessaire. (Image 3)
LES LIMITES DE L’ÉCHOGRAPHIE À 12 SEMAINES D’AMÉNORRHÉE
Les possibilités de dépistage du risque d’aneuploïdies à 12 SA sont désormais démontrées et possèdent une excellente sensibilité et peu de faux positifs.
Les progrès continus du dépistage chromosomique par ADN fœtal libre circulant (ADN lc) et les conditions de sa prise en charge vont certainement bouleverser la mise en place de ce dépistage et faire évoluer la pratique de l’échographie de 12 SA.
La mesure de la CN représente en effet non seulement un marqueur fiable du risque d’aneuploïdie mais également un marqueur de risque d’un certain nombre de pathologies fœtales notamment cardiaques ou encore celui d’autres aberrations chromosomiques non dépistées par l’ADN lc
Il est vraisemblable que dans un avenir proche le rôle de l’échographie de 12 SA avec les progrès constants de la technologie s’orientera de plus en plus vers l’analyse morphologique précoce au même titre que l’échographie du 2ème trimestre
Il importe donc d’évaluer, d’une part, la pertinence d’un tel dépistage précoce et, d’autre part, les conditions susceptibles d’impacter la qualité des résultats.
Une méta-analyse franco-britannique6 permet d’apporter des éléments de réponse. Elle comportait l’étude de 26 publications avec des protocoles échographiques variables non standardisés, entre 11 et 13 SA. Elle concernait plus de 210 000 fœtus.
Parmi ceux-ci, 3 groupes d’étude furent définis.
- Un premier groupe était constitué des fœtus porteurs d’anomalies majeures létales ou sévères découvertes dans une population non sélectionnée ou à faible risque (âge inférieur à 30 ans, absence d’antécédent familial, absence de comorbidité). La prévalence des anomalies était de 1,01% dans ce groupe. La sensibilité de l’échographie était de 46% (IC 95%, 36.8–55.4%).
- Le deuxième groupe était constitué des fœtus porteurs d’anomalies de tout type de gravité variable, létales ou sévères (celles du premier groupe), et ceux porteurs d’anomalies modérées ou mineures, extrait de la même population non sélectionnée ou à bas risque. La prévalence des anomalies était de 1,81%. La sensibilité de l’échographie était de 32,35% (IC 95%, 22,4-43,1%).
- Le troisième groupe était constitué des fœtus porteurs d’anomalies tout type (létales, sévères, modérées ou mineures) de gravité variable dans une population à haut risque identifié (CN supérieure à 3,0 mm, âge supérieur à 35 ans, antécédent personnel ou familial de pathologie fœtale). La prévalence était alors de 6,55%. La sensibilité de l’échographie était de 61,18% (IC 95%, 37,7-82,1%). (Figure 4)
Ainsi en population non sélectionnée, les anomalies non létales étaient dépistées 3 fois sur 10 et, en population à risque, plus de 6 fois sur 10. Cette différence est sans doute en rapport avec un dépistage orienté, une attention ciblée en fonction d’un risque identifié ou une plus grande expérience des praticiens.
Il semble que l’utilisation d’un protocole standardisé de dépistage échographique puisse représenter le meilleur moyen d’améliorer ce taux de détection.
Ainsi une étude monocentrique rétrospective chinoise7 avait mis en place un tel protocole. Il comportait l’analyse de 14 structures anatomiques. Plus de 53 000 femmes en population non sélectionnée avaient été étudiées. Au sein de cette cohorte, 3% des fœtus présentaient au moins une anomalie structurelle. La sensibilité du dépistage était de 43% (IC 95%, 40,6-45,5%) pour tout type d’anomalie, donc plus élevée que celui de l’étude précédente en population comparable.
Enfin, un certain nombre de facteurs limitants ne doivent pas être sous-estimés dans ce contexte. Il en existent 2 types : les facteurs évolutifs et les facteurs permanents.
Parmi les premiers, une anomalie peut être déjà présente mais non détectable car sans impact sur la morphologie échographique de l’organe cible ou de taille trop minime pour être détectable en raison de la résolution de l’imagerie. Elle peut à l’inverse ne pas être présente et se développer ultérieurement, ne devenant alors détectable qu’au 2ème ou au 3ème trimestre.
Parmi les seconds, l’obésité représente un obstacle majeur8 . Quel que soit le niveau de l’IMC supérieur à 30, le taux de détection des anomalies morphologiques, en particulier cardiaques et rachidiennes mais aussi celui des signes d’aneuploïdies, est plus bas, de 30 à 50% par rapport à un IMC inférieur à 30.
Autre obstacle enfin, la présence de fibromes dont le nombre, le volume, la localisation et la structure créent alors autant d’obstacles à la pénétration des ultrasons et nuisent à la qualité de l’imagerie.
CONCLUSION
Le dépistage des anomalies fœtales au premier trimestre de la grossesse repose donc sur 2 piliers : d’une part, l’échographie morphologique à 12 SA de plus en plus pertinente et, d’autre part, le dépistage du risque d’aneuploïdie par le calcul du risque combiné intégrant CN et marqueurs sériques. Ces 2 éléments doivent respecter de strictes conditions de réalisation avec des critères de qualité précis. Le développement récent de l’ADN lc représente un progrès indéniable dans la gestion du risque chromosomique mais ne pourra pas se substituer à l’échographie : en l’état actuel des connaissances près de 95% des anomalies découvertes à l’échographie de 12 SA ne seraient pas dépistées par cette technique. Il pourra en revanche se substituer dans un avenir proche aux marqueurs sériques actuels dans l’évaluation du risque d’aneuploïdie.
Connaître les conditions de réalisation, les possibilités mais aussi les limites de cette échographie sont des éléments indispensables à l’information éclairée des femmes.
L’auteur ne déclare pas de liens d’intérêts en relation avec cet article.
Joël Créquat, Laurence Teboul-Faure, Centre Péreire, Paris
RÉFÉRENCES
- Rapport du Comité Technique de l’Échographie de Dépistage Prénatal http://www.cfef.org/archives/bricabrac/lettres/DocusCTE/rapportCTE.pdf
- Conférence Nationale de l’Échographie Obstétricale et Fœtale http://www.cfef.org/archives/bricabrac/cneof/rapportcneof2016.pdf
- ISUOG Practice Guidelines: performance of first-trimester fetal ultrasound scan Ultrasound Obstet Gynecol 2013 ; 41: 102–113
- Pandya PP, Snijders RJM, Johnson SP, Brizot ML, Nicolaides KH. Screening for fetal trisomies by maternal age and fetal nuchal translucency thickness at 10–14 weeks of gestation. Br J Obstet Gynaecol 1995; 102: 957–62.
- A Herman, R Maymon, E Dreazen et al Nuchal translucency audit: a novel image-scoring method Ultrasound Obstet Gynecol 1998 ; Dec;12(6):398-403.
- J. N. Karim, N. W. Roberts, L. J. Salomon et al Systematic review of first-trimester ultrasound screening for detection of fetal structural anomalies and factors that affect screening performance Ultrasound Obstet Gynecol 2017; 50: 429–441
- Y. Liao, H. Wen, S. Ouyang et al Routine first-trimester ultrasound screening using a standardized anatomical protocol. Am J Obstet Gynecol 2021;224:396
- J. Y. Mei, Y. Afshar, L. D. Platt First-Trimester Ultrasound. Obstet Gynecol Clin N Am 46 (2019) 829–852








37 commentaires