Le dépistage du cancer du col de l’utérus repose sur la cytologie, le dépistage primaire HPV et les co-tests HPV-cytologie. Plusieurs points ne sont pas résolus : le triage optimal des femmes HPV positives, l’âge de début et de fin du dépistage et l’intervalle optimal de dépistage. Il faut également envisager une approche intégrée de la mise en œuvre de la vaccination anti HPV et du dépistage HPV.
Chaque stratégie de dépistage doit peser les avantages et les inconvénients potentiels de l’intervention. L’objectif du dépistage du cancer du col de l’utérus est la prévention du cancer du col de l’utérus par la recherche et le traitement des lésions précancéreuses. La cytologie est bien établie mais l’outil demeure imparfait, ainsi un tiers des cancers du col sont observés chez des femmes ayant reçu un frottis de dépistage dans l’intervalle recommandé de 3 ans. Par ailleurs, il n’est actuellement pas possible de distinguer les pré-cancers vrais des lésions morphologiquement similaires qui ne progresseraient pas vers le cancer (1). Beaucoup de CIN2 régressent spontanément (2), et seulement un sous-ensemble de CIN3 progressera en cancer (3). Ainsi, les programmes de dépistage actuels acceptent beaucoup de sur-traitements pour atteindre une sécurité élevée. Entre des mains non initiées les dommages associés au traitement par excision peuvent comporter parfois des complications obstétricales (4).
Aujourd’hui, trois approches de dépistage du cancer du col de l’utérus ont été recommandées par les comités d’experts ou approuvées par les autorité de santé locales.
Le dépistage cytologique est toujours l’approche la plus utilisée, c’est le cas en France où aucune nouvelle recommandation sur ce dépistage n’est proposée depuis des décennies.
Le dépistage primaire HPV a récemment été approuvé et recommandé aux États-Unis et bientôt introduit aux Pays-Bas. D’autres pays (GB, Australie, Suède, Canada) envisagent de passer au dépistage primaire HPV et plusieurs études pilotes ou de mise en œuvre sont en cours.
Les co-tests HPV-cytologie pour le dépistage primaire ont été recommandés aux États-Unis, mais ne sont pas pris en compte ailleurs. Les algorithmes sont adoptés ou proposés dans différents contextes selon la modalité de dépistage, l’âge de début, l’intervalle de dépistage et la stratégie de sortie.
Une analyse rétrospective récemment publiée à partir d’une base de données de laboratoires de diagnostic a suggéré que le dépistage HPV pourrait ne pas détecter plus de cancers du col de l’utérus que la cytologie (5). Cependant, les limites de l’étude ont été soulignées reposant sur des estimations biaisées de la sensibilité pour les tests HPV et la cytologie (6).
Des essais randomisés à grande échelle ont démontré que le dépistage du HPV est plus efficace (+30 %) pour détecter le CIN3 au cours du premier cycle de dépistage comparativement à la cytologie. Dans une analyse groupée de quatre essais randomisés menés en Europe, le test HPV a fourni une plus grande protection contre le cancer invasif du col utérin par rapport à la cytologie. Le risque de cancer de 3 ans après un test HPV négatif était d’environ 70 pour cent inférieur comparé à une cytologie négative (7). De plus, une grande étude observationnelle aux USA a démontré que la détection supplémentaire des lésions de CIN3+, quand la cytologie est ajoutée au test de HPV, est minime comparée à l’option d’effectuer un frottis seulement dans la situation de triage des HPV positifs.
Toutes les stratégies de dépistage primaires nécessitent un triage supplémentaire des femmes dépistées positives. Dans le dépistage cytologique, le triage est depuis longtemps recommandé pour les femmes présentant un ASCUS, soit en utilisant la cytologie répétée ou le test HPV (8). Lors d’un co-test cytologie et HPV, des tests répétés ou un triage sont recommandés pour les femmes HPV positives ayant une cytologie normale.
Dans le dépistage primaire HPV, proposé après 30 ans, toutes les femmes positives nécessitent un triage. Il est plus efficace d’effectuer un test de triage à partir de l’échantillon de dépistage primaire (triage réflexe), plutôt que d’inviter les femmes à revenir pour un nouveau prélèvement.
■ Cytologie de triage des HPV+
Tous les programmes de dépistage HPV, suggérés ou approuvés, utilisent la cytologie pour le triage. En raison de l’augmentation du risque de précancers chez les femmes HPV positives, et parce que cette approche permet d’exclure un grand nombre de cas à très faible risque de cancer (p. Ex. ASC-US HPV neg), la cytologie devrait avoir un meilleur résultat en triage comparé au dépistage primaire. Des études récentes ont rapporté une sensibilité accrue de la cytologie pour la détection des précancers lorsqu’elle est proposée après (et pas avant) la connaissance du statut du HPV, avec cependant une perte potentielle de spécificité (9).
En Hollande, la cytologie est recommandée pour le triage de toutes les femmes HPV-positives, alors qu’aux États-Unis, la cytologie a été approuvée pour le triage de HPV positif, HPV16 / 18 négatif.
■ Génotypage des HPV en triage des HPV+
Dans le pool de 13 à 14 types des HPV oncogènes, le risque de précancer et de cancer varie nettement pour chaque type, ce qui indique l’intérêt potentiel du génotypage des HPV pour la stratification du risque.
Cependant, le génotypage HPV seul ne peut pas faire la différence entre une infection transitoire et un précancer ou un cancer. De façon constante dans le monde entier, HPV16 est de loin le marqueur de risque le plus élevé de CIN3+, alors que les associations de risque pour certains types moins à risque peuvent varier d’une population à l’autre (10). Puisque le génotypage individuel complet n’est pas cliniquement utile, il existe un débat sur les types qui devraient être inclus dans les tests de génotypage HPV. HPV16 et HPV18, et moins fréquemment HPV45, sont couramment inclus dans les tests de typage. Une étude récente, évaluant le risque absolu de CIN2 + lié à des génotypes individuels, a révélé un risque pour HPV33 semblable à HPV16, ce qui suggère qu’il pourrait être inclus dans les tests de génotypage HPV (11). Cependant, une étude similaire utilisant la CIN3+ a trouvé un classement différent des types de HPV derrière HPV16 (12).
Parmi les études, on s’accorde à penser que le groupe à risque le plus élevé comprend en 1er HPV 16 et le groupe à risque le plus faible, HPV 39, 56, 59, 66 et 68.
En raison de son risque élevé de cancer et d’association particulièrement forte avec les adénocarcinomes, le HPV18 est généralement inclus dans les tests de génotypage, même si pour les CIN3 il peut être présent en 4e position. L’étude Athéna, portant sur plus de 47 000 femmes en dépistage, a permis de mesurer le risque de CIN3+ dans la population générale : il est de 15 % pour le portage HPV 16, de 9 % pour HPV 18, de 8 % pour l’HPV 31, de 5.4 % pour l’HPV 33 et de 4.3 % pour l’HPV 45.(13) (Tableau 1).
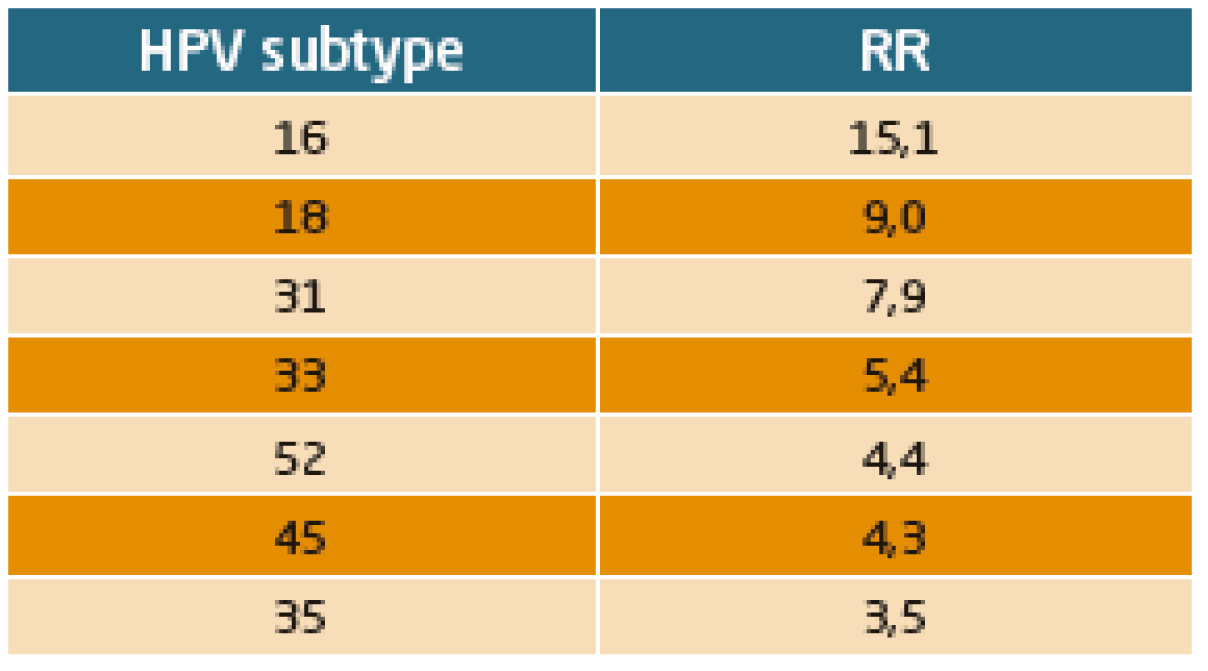
Tableau 1 : Risque de CIN 3+ ATHENA, femmes +30 ans – Monsonego, Gynecol Oncol 2015
L’inclusion supplémentaire de génotypes augmente la sensibilité au prix d’une spécificité plus faible et augmente le nombre de colposcopies.
■ La p16 en triage des HPV+
P16 est uniformément régulée à la hausse dans le processus de transformation induite par l’HPV. Elle a été évaluée comme un marqueur des CIN3. En histologie, la coloration p16 peut être utilisée pour différencier les pré-cancers des lésions morphologiquement similaires et a été recommandée pour affiner le diagnostic histologique des CIN (10). Un test cytologique a été développé pour le dépistage et le triage, combinant la détection de p16 et le marqueur de prolifération Ki 67 (double coloration). Le marquage a été évalué à la fois pour le dépistage primaire et pour le triage des HPV positifs (15).
Les données provenant d’un grand essai de dépistage italien et aux États-Unis suggèrent que les femmes HPV positives, qui sont p16 ou double marquage positif, devraient être adressées en colposcopie, tandis que le suivi peut être prolongé au-delà d’un an chez les femmes p16 négatives (9).
■ Autres marqueurs dans le triage des HPV+
Une augmentation de la méthylation de plusieurs gènes hôtes a été observée chez les femmes présentant une CIN3 ou un cancer, comparée à une simple infection à HPV (16). Les marqueurs de méthylation indiquent des performances similaires pour le triage de femmes HPV-positives comparé à la cytologie de triage. Les avantages des tests de méthylation par rapport à la cytologie incluent l’objectivité du résultat et la possibilité de l’exploiter dans les échantillons auto-collectés, comme démontré dans un essai randomisé aux Pays-Bas (17). Récemment, des études ont montré que les génomes des HPV sont de plus en plus méthylés lors du passage de l’infection HPV au CIN3 (18).
D’autres marqueurs, y compris la détection d’anomalies chromosomiques, l’ARNm oncogène viral ou les protéines virales E6 et E7, ont été développés, mais une évaluation rigoureuse dans un cadre du triage des HPV positifs fait encore défaut.
■ Le dépistage basé sur le risque
En raison des progrès réalisés dans la compréhension du HPV et de l’histoire naturelle du cancer du col utérin, il existe maintenant de nombreuses options différentes pour le dépistage et le triage. En utilisant différents tests, il est maintenant possible de prédire le risque individuel de pré-cancer avec une très grande précision.
Cependant, l’abondance des choix est un défi, puisque les recommandations de dépistage et de gestion peuvent devenir de plus en plus compliquées.
Des orientations récentes ont adopté une approche basée sur le risque dans le dépistage, le triage, la prise en charge et le traitement. Cette approche met l’accent sur le risque absolu de pré-cancer chez les femmes testées positives et négatives (19). Il est important de noter que les différentes estimations des risques ne sont pertinentes que lorsqu’elles se traduisent par une gestion clinique différente. Il existe environ quatre niveaux d’action clinique différents : au risque le plus faible, les femmes reviennent à des intervalles de dépistage réguliers. Dans un groupe à risque intermédiaire, des tests supplémentaires ou une surveillance accrue peuvent être nécessaires.
Ensuite, le seuil de référence pour réaliser une colposcopie, et enfin, au niveau de risque le plus élevé, les femmes sont traitées.
■ Dépistage des populations vaccinées
Au cours de la dernière décennie, la vaccination HPV a été mise en œuvre dans la majorité des pays développés. La vaccination systématique est généralement proposée aux femmes âgées de 11 à 13 ans, mais de nombreux pays ont également mis en oeuvre une vaccination de rattrapage. Dans de nombreux pays, les cohortes vaccinées arrivent maintenant dans celles admissibles au dépistage.
Désormais le risque résiduel de cancer du col dépend non seulement des antécédents de dépistage, mais aussi de la vaccination, en particulier du type de couverture vaccinale, de la vaccination dans les programmes de rattrapage, ou même si la vaccination dans la population générale a conduit à l’immunité du troupeau.
Deux approches ont été proposées pour la gestion du dépistage du cancer du col de l’utérus dans le contexte de la variation des risques liés au vaccin. Les données de génotypage HPV issues de deux grands essais de dépistage (POBASCAM et NTCC) suggèrent qu’il peut être possible de définir différents intervalles de dépistage pour les femmes non vaccinées et les vaccinées HPV négatives, bien que le risque d’infection HPV chez les femmes vaccinées reste présent. Cependant, l’utilisation du statut de vaccination pour modifier les stratégies de dépistage pose des problèmes logistiques, car des registres complets sont nécessaires et doivent être accessibles lors de la visite de dépistage du col de l’utérus. Une autre stratégie de dépistage utilise la même approche pour les femmes non vaccinées et vaccinées (c’est le cas de la France), de sorte qu’une connaissance précise de l’état de vaccination d’un individu n’est pas nécessaire. Le dépistage primaire HPV, en particulier s’il implique un génotypage partiel pour les types de risque les plus élevés, offre une telle possibilité, du moins pour les cohortes vaccinées avec des vaccins de première génération. Une femme dépistée, qui est HPV positif, peut être traitée sur cette base, sans avoir besoin d’avoir des informations sur l’état de vaccination – ce qui compte, c’est son statut HPV le jour du dépistage.
Dans le contexte des vaccins de première génération, pour les femmes HPV négatives, l’intervalle peut être adapté au groupe le plus à risque dans la population, c’est-à-dire les femmes non vaccinées. Même avec une telle approche conservatrice, l’intervalle de dépistage pourrait être étendu à cinq ans.
Les vaccins de la prochaine génération sont susceptibles d’avoir un impact supplémentaire sur la stratégie optimale de dépistage du cancer du col. Mais leur impact sur les programmes de dépistage sera retardé pendant des décennies, puisqu’ils sont « intégrés » dans les programmes de vaccination existants qui ciblent principalement les adolescentes de 11-12 ans. Pour ces cohortes,
si la couverture vaccinale est élevée, il est probable qu’à long terme, une femme aura besoin de très peu de cycles de dépistage au cours de sa vie. Les premières analyses suggèrent que le nombre le plus efficient de tests de dépistage offerts aux cohortes ayant reçu des vaccins multivalents sera très variable en fonction de la couverture vaccinale.
■ Conclusion
En conclusion, parmi les questions importantes qui doivent être abordées, figurent le triage optimal des femmes HPV positives, l’âge de début et de fin du dépistage et l’intervalle optimal de dépistage. Le défi consiste à accélérer une approche intégrée de la mise en oeuvre de la vaccination anti HPV et du dépistage HPV.
Pour la plupart des pays, une approche pragmatique et unifiée, pour les femmes non vaccinées et vaccinées, semble la plus appropriée. Avec une telle approche, les femmes HPV-négatives sont toutes gérées sur la base du risque le plus élevé chez les femmes non vaccinées.
En résumé, la compréhension de la carcinogenèse liée au HPV a conduit à la mise au point de nombreux outils pour la prévention du cancer au cours de la dernière décennie. Mais il n’existe évidemment pas d’approche « sur mesure » : le défi réside désormais dans la mise en oeuvre optimale de ces outils dans des contextes très différents.
L’auteur Joseph Monsonego déclare n’avoir aucun lien d’intérêt pour cet article.
RÉFÉRENCES
1. Schiffman M, Wentzensen N. A Suggested Approach to Simplify and Improve Cervical Screening in the United States. J Low Genit Tract Dis 2016 Jan;20(1):1-7.
2. Castle PE, Schiffman M, Wheeler CM, Solomon D. Evidence for frequent regression of cervical intraepithelial neoplasia- grade 2. Obstet Gynecol 2009 Jan;113(1):18-25.
3. McCredie MR, Sharples KJ, Paul C, Baranyai J, Medley G, Jones RW, Skegg DC. Natural history of cervical neoplasia and risk of invasive cancer in women with cervical intraepithelial neoplasia 3: a retrospective cohort study. Lancet Oncol 2008 May;9(5):425-34.
4. Kyrgiou M, Mitra A, Arbyn M, Paraskevaidi M, Athanasiou A, Martin-Hirsch PP, Bennett P, Paraskevaidis E. Fertility and early pregnancy outcomes after conservative treatment for cervical intraepithelial neoplasia. Cochrane Database Syst Rev 2015;9:CD008478.
5. Blatt AJ, Kennedy R, Luff RD, Austin RM, Rabin DS. Comparison of cervical cancer screening results among 256,648 women in multiple clinical practices. Cancer Cytopathol 2015 May;123(5):282-8.
6. Giorgi RP, Ronco G, Dillner J, Elfstrom KM, Snijders PJ, Arbyn M, Berkhof J, Carozzi F, Del MA, de SS, Bosch X, Petry KU, et al. Why follow-back studies should be interpreted cautiously:
The case of an HPV-negative cervical lesion. Cancer Cytopathol 2016 Jan;124(1):66-7.
7. Ronco G, Dillner J, Elfstrom KM, Tunesi S, Snijders PJ, Arbyn M, Kitchener H, Segnan N, Gilham C, Giorgi-Rossi P, Berkhof J, Peto J, et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet 2014 Feb 8;383(9916):524-32.
8. Arbyn M, Roelens J, Simoens C, Buntinx F, Paraskevaidis E, Martin-Hirsch PP, Prendiville WJ. Human papillomavirus testing versus repeat cytology for triage of minor cytological cervical lesions. Cochrane Database Syst Rev 2013;3:CD008054.
9. Wentzensen N, Fetterman B, Castle PE, Schiffman M, Wood SN, Stiemerling E, Tokugawa D, Bodelon C, Poitras N, Lorey T, Kinney W. p16/Ki 67 Dual Stain Cytology for Detection of Cervical Precancer in HPV-Positive Women. J Natl Cancer Inst 2015 Dec;107(12):djv257.
10. Khan MJ, Castle PE, Lorincz AT, Wacholder S, Sherman M, Scott DR, Rush BB, Glass AG, Schiffman M. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst 2005 Jul 20;97(14):1072-9.
11. Cuzick J, Ho L, Terry G, Kleeman M, Giddings M, Austin J, Cadman L, Ashdown-Barr L, Costa MJ, Szarewski A. Individual detection of 14 high risk human papilloma virus genotypes by the PapType test for the prediction of high grade cervical lesions. J Clin Virol 2014 May;60(1):44-9.
12. Schiffman M, Burk RD, Boyle S, Raine-Bennett T, Katki HA, Gage JC, Wentzensen N, Kornegay JR, Aldrich C, Tam T, Erlich H, Apple R, et al. A study of genotyping for management of human papillomavirus-positive, cytology-negative cervical screening results. J Clin Microbiol 2015 Jan;53(1):52-9.
13. Monsonego J , Cox J. T b, Behrens C , Sandri M ,. Franco EL Yap PS , Huh W, Prevalence of high-risk human papilloma virus genotypes and associated risk of cervical precancerous
lesions in a large U.S. screening population Gynecol Oncol. 2015 Apr;137(1):47-54.
14. Darragh TM, Colgan TJ, Cox JT, Heller DS, Henry MR, Luff RD, McCalmont T, Nayar R, Palefsky JM, Stoler MH, Wilkinson EJ, Zaino RJ, et al. The Lower Anogenital Squamous Terminology Standardization Project for HPV-Associated Lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology. J Low Genit Tract Dis 2012 Jul;16(3):205-42.
15. Ikenberg H, Bergeron C, Schmidt D, Griesser H, Alameda F, Angeloni C, Bogers J, Dachez R, Denton K, Hariri J, Keller T, von Knebel DM, et al. Screening for cervical cancer precursors with p16/Ki 67 dual-stained cytology: results of the PALMS study. J Natl Cancer Inst 2013 Oct 16;105(20):1550-7.
16. De Strooper LM, van ZM, Steenbergen RD, Bleeker MC, Hesselink AT, Wisman GB, Snijders PJ, Heideman DA, Meijer CJ. CADM1, MAL and miR124-2 methylation analysis in cervical scrapes to detect cervical and endometrial cancer. J Clin Pathol 2014 Dec;67(12):1067-71.
17. Verhoef VM, Bosgraaf RP, van Kemenade FJ, Rozendaal L, Heideman DA, Hesselink AT, Bekkers RL, Steenbergen RD, Massuger LF, Melchers WJ, Bulten J, Overbeek LI, et al. Triage by methylation-marker testing versus cytology in women who test HPV-positive on self-collected cervicovaginal specimens (PROHTECT-3): a randomised controlled non-inferiority trial. Lancet Oncol 2014 Mar;15(3):315-22.
18. Mirabello L, Sun C, Ghosh A, Rodriguez AC, Schiffman M, Wentzensen N, Hildesheim A, Herrero R, Wacholder S, Lorincz A, Burk RD. Methylation of human papillomavirus type 16 genome and risk of cervical precancer in a Costa Rican population. J Natl Cancer Inst 2012 Apr 4;104(7):556-65.
19. Arbyn M, Roelens J, Martin-Hirsch P, Leeson S, Wentzensen N. Use of HC2 to triage women with borderline and mild dyskaryosis in the UK. Br J Cancer 2011 Sep 27;105(7):877-80.






10 commentaires