En fonction de l’âge de la femme et du résultat du bilan de l’infertilité, la prise en charge du couple infertile fera appel à l’induction de l’ovulation par le citrate de clominofène ou les gonadotrophines, à la chirurgie des trompes, au traitement chirurgical de l’endométriose et aux techniques d’aide médicale à la reproduction, insémination intra-utérine ou fécondation in vitro.
L’infertilité représente actuellement un réel problème de santé publique puisqu’environ 15 % à 25 % des couples en âge de procréer consultent pour infertilité (1).
La majorité des grossesses spontanées survient dans les 6 premiers mois de rapports sexuels réguliers non protégés et l’infertilité se définit par une absence de conception après 12 mois ou plus (2, 3).
Il est important de rappeler que les chances de concevoir naturellement sont de 25 % à 25 ans, 12 % à 35 ans et seulement de 6 % à 40 ans (4).
Il est donc actuellement recommandé de débuter les explorations pour infertilité après 1 an d’essai de grossesse et bien sûr avant en cas de troubles patents. Par ailleurs, si la femme a plus de 35 ans, une prise en charge dès 6 mois est nécessaire, voire même sans délai pour les femmes de plus de 38 ans (5, 7).
Le choix du traitement de l’infertilité se fera donc en fonction de l’âge de la patiente et des résultats du bilan complet d’infertilité, tout en tenant compte également de la préférence du couple. Avant tout traitement, la première étape est la prise en charge du tabagisme et de l’obésité qui allonge les délais de conception, diminuent les taux de succès des traitements de l’infertilité et augmentent les complications obstétricales (6).
On distingue trois types de traitement dans la prise en charge du couple infertile ; le traitement médical, le traitement chirurgical et l’assistance médicale à la procréation (AMP) qui comprend l’insémination intra-utérine, la fécondation in vitro (FIV) et la fécondation assistée par injection intra-cytoplasmique (ICSI).
Cet article présente un aperçu actualisé des traitements du couple infertile en s’appuyant sur les recommandations de bonne pratique du CNGOF de 2010 (7).
Le traitement médical
L’induction de l’ovulation par le Citrate de Clomifène (CC) suivie de rapport sexuel programmé est recommandée comme traitement de première intention de l’infertilité par anovulation ou dysovulation de la classe 2 de l’OMS : c’est-à-dire le syndrome des ovaires polykystiques (SOPK) et les anovulations normogonadotropes sans autres causes d’infertilité associée chez la femme jeune (7, 8). En revanche chez les femmes à ovulation normale, et notamment dans l’infertilité inexpliquée, il n’est pas montré de bénéfice d’un traitement par CC seul sur les chances de survenue d’une grossesse (9).
Le citrate de clomifène bloque les récepteurs œstrogéniques au niveau de l’axe hypothalamo-hypophysaire et provoque ainsi une augmentation de sécrétion GnRH, FSH et LH. Son mode d’action justifie donc une prescription en début de cycle, au moment où les follicules sensibles aux gonadotrophines ont besoin de FSH pour amorcer leur croissance terminale. L’action anti-œstrogène serait, par contre, néfaste pour la topicité endométriale et la sécrétion de glaire cervicale.
Il est recommandé de débuter le traitement le plus tôt possible dans le cycle par 50 à 150 mg/jour pendant 5 jours, de l’adapter au poids et à la réponse de la patiente et de pratiquer une surveillance échographique et hormonale de l’efficacité et du risque de grossesses multiples (8, 10). Comme toute stimulation de l’ovulation, il ne doit plus jamais être prescrit sans avoir pris connaissance des résultats de l’hystérographie et du spermogramme.
Le citrate de clomifène permet de rétablir une ovulation chez 60 % à 80 % des patientes avec des taux de grossesses de 15 % à 25 % par cycle (11, 8).
Il est recommandé de ne pas dépasser 6 cycles pour des raisons d’efficacité et de sécurité (7). Dans les années 1990, plusieurs études ont montré une augmentation du risque de cancer de l’ovaire après 12 cycles de citrate de clomifène (14, 15). Des données plus récentes sur de grandes cohortes sont plutôt rassurantes concernant le risque de cancer de l’ovaire. En revanche, il y est rapporté une augmentation du risque de cancer de l’endomètre si le CC est pris pendant plus de 6 cycles (16, 17, 18).
Il n’a jamais été démontré que l’administration d’hCG ou d’œstrogènes destinés à favoriser la sécrétion de glaire cervicale améliorent les résultats (12).
Le CC stimulant aussi bien la sécrétion de LH que celle de FSH, il n’y a pas d’insuffisance lutéale et l’apport de progestérone en deuxième partie de cycle n’a pas montré son efficacité (13).
Le bénéfice d’un traitement par metformine, seul ou associé au clomifène chez les patientes présentant un SOPK, reste discuté à ce jour dans la littérature. Une revue Cochrane récente qui reprenait 38 essais
conclut qu’aucune preuve n’indique que la metformine améliore les taux de naissances vivantes, qu’elle soit utilisée seule ou en combinaison avec le CC (19).
L’administration pulsatile de GnRH est recommandée en première intention et uniquement dans l’anovulation d’origine hypothalamique (maigreur, anorexie mentale) après une prise en charge hygiéno-diététique et psychologique (7). Elle permet de restaurer un cycle ovulatoire par sécrétion physiologique de gonadotrophine dans 75 % à 95 % des cas, avec selon les auteurs un taux cumulatif de grossesses après 6 cycles de 70 à 90 % (20, 21).
L’ovulation peut également être induite par des gonadotrophines notamment en alternative à la pompe à LHRH dans l’anovulation hypothalamo-hypophysaire ou en cas d’échec au CC (7).
Il existe à l’heure actuelle plusieurs types de gonadotrophines commercialisées qui ne semblent pas présenter de différences significatives en termes de grossesses lorsqu’elles sont utilisées dans l’induction de l’ovulation (8).
Le schéma thérapeutique sera adapté en fonction de l’indication, de l’âge de la patiente et de sa réponse ovarienne. En cas de syndrome des ovaires polykystiques, le protocole «step-up chronic low dose» avec des doses de départs modérées, augmentées lentement et prudemment par paliers est recommandé (7).
Une surveillance par le dosage de l’œstradiol et de la LH et une échographie folliculaire, ainsi que le respect des critères de déclenchement de l’ovulation, sont indispensables pour prévenir le risque de grossesse multiple et d’hyperstimulation (10). Un soutien de la phase lutéale est nécessaire dans les inductions de l’ovulation par gonadotrophines car, contrairement au CC, elles semblent provoquer une insuffisance lutéale par réduction de la durée de vie du corps jaune (22).
Chirurgie de la reproduction
Les indications chirurgicales de l’infertilité féminine doivent impérativement intégrer tous les facteurs associés comme l’âge et les autres causes d’infertilité du couple qui pourraient remettre en question l’efficacité du geste chirurgical dans l’amélioration de la fertilité. En cas d’échec du citrate de clomifène, lorsqu’il existe un risque élevé d’hyperstimulation ou une contre-indication à la grossesse multiple, un drilling ovarien cœlioscopique peut être proposé comme alternative aux gonadotrophines. Il a effectivement été montré, dans une méta-analyse récente, l’absence de différence des taux de grossesses entre ces deux alternatives en 2e intention, néanmoins il était retrouvé moins d’hyperstimulation ovarienne et de grossesses multiples en cas de pratique du drilling ovarien (23). L’efficacité de ce traitement est maximale dans les 6 mois suivant l’intervention mais peut persister plus longtemps.
En cas d’infertilité tubaire, les recommandations varient selon le type de lésions. En cas d’obstruction distale, la pratique d’une fimbrioplastie ou d’une néosalpingostomie, en cas de bon pronostic tubaire et si les autres paramètres de fertilité du couple le permettent, est recommandée (7). Il n’existe néanmoins aucune donnée dans la littérature comparant la chirurgie tubaire distale à la FIV d’emblée.
En cas d’hydrosalpinx, il est démontré que la salpingectomie ou l’occlusion tubaire proximale améliorent les résultats en FIV, et ce d’autant plus que l’hydrosalpinx est visible à l’échographie (24).
En cas d’absence d’obstruction proximale et en dehors d’un contexte infectieux pelvien, un cathétérisme sélectif peut être envisagé si la patiente est jeune et qu’il n’existe aucune autre cause d’infertilité. Le recours à la FIV d’emblée est recommandé en cas d’atteinte tubaire multifocale ou étendue (7).
En ce qui concerne la prise en charge de l’endométriose, dans un contexte d’infertilité, en cas de lésions péritonéales minimes ou légères (stades I/II de l’AFS), le bénéfice en terme de fertilité de la destruction cœlioscopique des lésions est discuté dans la littérature (25). Lorsque les lésions sont sévères et profondes, le traitement cœlioscopique améliore la fertilité mais expose à des complications. Il faut donc adapter la stratégie au rapport bénéfice/risque individuel de la patiente en tenant compte de tous les paramètres de fertilité associés (7). L’existence d’un endométriome de plus de 3 à 5 cm est reconnue comme alertant la fertilité spontanée et plusieurs études de cohorte rétrospectives montrent un bénéfice à la kystectomie cœlioscopique, avec la survenue de grossesses spontanées dans 30 à 67 % des cas, dans les 12 mois en moyenne suivant l’intervention (26). En revanche, le traitement chirurgical des endométriomes avant AMP n’est pas recommandé, sauf en cas de symptomatologie invalidante associée, de kyste supérieur à 6 cm, ou en cas de doute diagnostique concernant la nature histologique de la lésion (7).
La cœlioscopie systématique ne fait plus partie du bilan d’infertilité mais elle s’impose en cas d’obstruction tubaire ou d’antécédents évocateurs de lésions péritonéo-pelviennes (7).
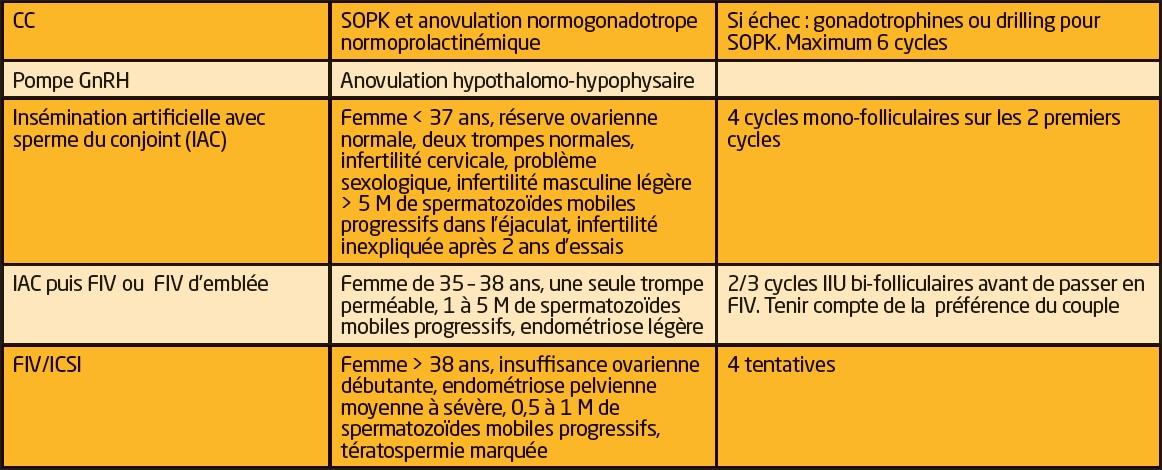 Indications des traitements de l’infertilité
Indications des traitements de l’infertilité
Les techniques d’aide médicale à la procréation
L’insémination intra-utérine (IIU)
L’insémination intra-utérine est, à ce jour, la technique d’AMP la moins invasive, contraignante et coûteuse. En France, l’IIU occupe une large place puisqu’elle représente 40 % de l’activité d’AMP d’après le rapport d’activité de l’Agence de Biomédecine de 2015.
Il est recommandé qu’une stimulation de l’ovulation par gonadotrophine, associée ou non au citrate de clomifène, accompagne l’insémination intra-utérine (7, 27).
En revanche, le CC seul, sans être associé aux gonadotrophines, n’a pas démontré son efficacité (28).
L’indication «historique» de l’IIU est l’infertilité cervicale, mise en évidence par l’absence de migration des spermatozoïdes dans la glaire cervicale grâce au test post-coïtal (TPC). Ce test souffre d’une grande hétérogénéité dans la définition de sa positivité dans la littérature ainsi que d’une grande variabilité inter-opérateur. Les principales études ne montrent pas de bénéfice du TPC pour la prédiction de grossesse naturelle. Il n’est plus recommandé, en France, que dans l’infertilité inexpliquée, pour distinguer les infertilités cervicales des vraies inexpliquées (7, 29).
Aucune IIU ne doit être réalisée sans avoir vérifié la perméabilité tubaire et le spermogramme. La loi de bioéthique de 2011 exige un test de survie, une spermoculture et des sérologies (HIV, hépatites B et C, syphilis) datant de moins de 3 mois avant la première IIU. La loi précise qu’il faut un nombre de spermatozoïdes mobiles après migration supérieur à 1 million, sinon le couple doit être adressé en FIV/ICSI.
Lorsque le délai d’infertilité est court, que la femme est jeune et qu’il n’existe aucune autre cause d’infertilité, une IIU sur trompe unilatérale peut être envisagée tout en ne méconnaissant pas le risque de GEU. Certains auteurs rapportent de meilleurs résultats lorsque l’atteinte tubaire est proximale (30).
De même, lorsque que la seule cause d’infertilité suspectée est l’existence d’une endométriose légère à modérée (stade I /II de l’AFS), plusieurs auteurs proposent une prise en charge de maximum 4 cycles d’IIU (31).
La plupart des études ont démontré que la grande majorité des grossesses surviennent dans les 3 à 4 premiers cycles d’IIU. Bien que l’assurance maladie prenne en charge 6 tentatives d’IIU, il convient donc de réévaluer l’indication après l’échec de 4 cycles (32). En ce qui concerne l’efficacité des IIU, un rapport récent de l’ABM, publié fin 2015, fait état d’un taux d’accouchement de 10 % parmi les 52 560 IIU intraconjugales réalisées en 2013 en France. Cette technique a donc comme inconvénient d’avoir des taux de succès par tentative plus faibles par rapport à la FIV ainsi qu’un risque de grossesse hyper-multiple moins bien contrôlé. Enfin, elle n’a pas l’apport diagnostique que peut avoir la FIV sur les causes possibles d’une infertilité inexpliquée telle que la qualité ovocytaire ou l’absence de fécondation. Contrairement aux idées reçues, il n’est pas obligatoire d’avoir recours aux IIU avant le recours à la FIV/ICSI. A partir de 38 ans, toutes les études récentes montrent que le recours direct à la FIV/ICSI offre de meilleurs résultats (33, 34).
La fécondation in vitro/injection intra-cytoplasmique ou FIV/ISCI
Initialement employée dans des indications tubaires absolues ou relatives, la FIV est aujourd’hui indiquée également en cas d’infertilité inexpliquée, masculine sévère, liée à une endométriose sévère ou après échecs des IIU (35).
L’indication de la FIV doit être portée d’emblée si le test de migration survie retrouve moins d’1 million de spermatozoïdes mobiles. En revanche, s’il retrouve moins de 500 000 spermatozoïdes, une tératospermie importante, une survie anormale ou encore plus de 80 % d’anticorps anti-spermatozoïdes, le recours à l’ICSI est indiqué (35).
Le rapport d’activité de l’agence de biomédecine de 2015 fait état de taux d’accouchement d’environ 20 % par ponction, identiques en FIV et en ICSI. 4 tentatives avec ponction et transfert par enfant (ou grossesse de plus de 22 semaines d’aménorrhée) sont actuellement prises en charge.
Victoria Maget – Assistante service de Gynécologie Obstétrique et Médecine de la Reproduction, Centre Hospitalier des Quatre villes-Saint-Cloud
Joëlle Belaisch-Allart – Chef du service de Gynécologie Obstétrique et Médecine de la Reproduction, Centre Hospitalier des Quatre villes-Saint-Cloud
L’auteur déclare les liens d’intérêt suivants : Collaboration avec toutes les firmes pharmaceutiques impliquées dans le domaine de la fertilité.
RÉFÉRENCES
1. Slama R. Estimation of the frequency of involuntary infertility on a nationwide basis. Hum Reprod. 2012 May;27(5):1489-98
2. Slama R. La fertilité des couples en France. Bulletin Epidémiologique Hebdomadaire, février 2012 n° 7-8-9
3. Zegers-Hochschild F. International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) revised glossary of ART terminology. Fertil Steril. 2009 Nov;92(5):1520-4
4. Schwartz D. Female fecundity as a function of age: results of artificial insemination in 2193 nulliparous women with azoospermic husbands. Federation CECOS. N Engl J Med. 1982 Feb 18;306(7):404-6
5. Fertility problems: assessment and treatment Nice guidelines February 2013
6. Clark AM. Weight loss in obese infertile women results in improvement in reproductive outcome for all forms of fertility treatment. Hum Reprod 1998;13:1502-5
7. Recommandations pour la pratique clinique. La prise en charge du couple infertile J Gynecol Obstet Biol Reprod 2010;39:S1-S342
8. AFSAPPS 2007
9. Hughes E. Clomiphene citrate for unexplained subfertility in women. Cochrane Database Syst Rev. 2000;(2):CD000057
10. Jacquesson L. L’induction de l’ovulation. J Gynécol Obstét Biol Reprod, Volume 39, Issue 8, Pages S67-S74
11. Use of clomiphene citrate in women.Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2006 Nov;86:S187-93
12. George K. Ovulation triggers in anovulatory women undergoing ovulation induction.Cochrane Database Syst Rev. 2014 Jan 31;1:CD006900
13. AFSSAPS 2004
14. Rossing MA. A casecontrol study of ovarian cancer in relation to infertility and the use of ovulation-inducing drugs. Am J Epidemiol(2004) 160:1070-1078
15. Whittemore AS, Itnyre J and the Collaborative Ovarian Cancer Group. Characteristics relating to ovarian cancer risk: Collaborative analysis of 12 US case-control studies. II. Invasive epithelial ovarian cancers in white women. Am J Epidemiol (1992) 136:1184-1203
16. Dauplat J. Comparison of dysplasia profiles in stimulated ovaries and in those with a genetic risk for ovarian cancer. Eur J Cancer. 2009 Nov;45(17):2977-83
17. Jensen A. Use of fertility drugs and risk of uterine cancer: results from a large Danish population-based cohort study. Am J Epidemiol. 2009 Dec 1;170(11):1408-14
18. Calderon-Margalit R. Cancer risk after exposure to treatments for ovulation induction. Am J Epidemiol 2009 Feb 1;169(3):365-75
19. Tang T. May Insulinsensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev. 2012
20. Filicori M, Falbo A J Clin Treatment of anovulation with pulsatile gonadotropin-releasing hormone: prognostic factors and clinical results in 600 cycles. Endocrinol Metab. 1994 Oct;79(4):1215-20
21. Christin-Maitre S. Groupe Français des pompes à GnRH. Pregnancy outcomes following pulsatile GnRH treatment: results of a large multicenter retrospective study. Journal de Gynecologie, Obstetrique et Biologie de la Reproduction [2007, 36(1):8-12]
22. Hédon B. L’induction de l’ovulation en pratique de ville. Mises à jour en Gynécologie et Obstétrique Tome XXXII publié le 3.12.2008 32e journées nat. CNGOF 2008 Paris
23. Farquhar C. Role of tubal surgery in the era of assisted Laparoscopic ‘drilling’ by diathermy or laser for ovulation induction in anovulatory polycystic ovary syndrome. Cochrane Database Syst Rev. 2007 Jul 18;(3):CD001122
24. Practice Committee of American Society for Reproductive Medicine. Repproductive technology : a committee opinion. Fertil Steril. 2015 Jun;103(6):e37-43
25. Yazbeck C. La chirurgie de la reproduction Journal de Gynécologie Obstétrique et Biologie de la Reproduction, Volume 39, Issue 8, PagesS57-S87
26. Sutton CJ. Laser laparoscopic surgery in the treatment of ovarien endometriomas. J Am Assoc Gynecol Laparosc 1997;4:319-23
27. Mangianiello P. A comparison of clomiphene citrate and human menopausal gonadotropin for use in conjunction with intra insemination. Fertil Steril, 1997, 66, 405-412.
28. Dickey R. Sequential clomiphene citrate and human menopausal gondotrophin for ovulation induction: comparison to clomiphene citrate alone and human menopausal gonadotrophin alone. Hum Reprod, 1993, 8, 56-59
29. Scholten I. Long term outcome in subfertile couples with isolated cervical factor. Europ J Obst Gyn Rep Biol 2013, 170; 429-433
30. Farhi J. Role of treatment with ovarian stimulation and intrauterine insemination in women with unilateral tubal occlusion diagnosed by hysterosalpingography. Fertil Steril. 2007 Aug;88(2):396-400
31. Van der Houwen LE. Efficacy and safety of intrauterine insemination in patients with moderate-to-severe endometriosis. Reprod Biomed Online. 2014 May;28(5):590-8.
32. Belaisch-Allart J. Intrauterine insemination: ovarian stimulation or not? Gynecol Obstet Fertil. 2007 Sep;35(9):871-6.
33. Wiser A. Ovarian stimulation and intrauterine insemination in women aged 40 years or more. Reprod Biomed Online 2012;24:170-3
34. Goldman M. A randomized clinical trial to determine optimal infertility treatment in older couples: the Forty and Over Treatment Trial (FORT-T).Fertil Steril 2014; 101:1574-81
35. Amar-Hoffet A. Place des techniques d’assistance médicale à la procréation
Article paru dans le Genesis N°187 (novembre/décembre 2015)







20 commentaires